TOPNOST ETILMALTOLA V PLINIH PRI VISOKIH TLAKIH
|
|
|
- Martin Maxwell
- 5 years ago
- Views:
Transcription
1 UNIVERZA V MARIBORU FAKULTETA ZA KEMIJO IN KEMIJSKO TEHNOLOGIJO Lidija Repas TOPNOST ETILMALTOLA V PLINIH PRI VISOKIH TLAKIH Diplomsko delo Maribor, oktober 2010
2 UNIVERZA V MARIBORU FAKULTETA ZA KEMIJO IN KEMIJSKO TEHNOLOGIJO Diplomsko delo visokošolskega strokovnega študija TOPNOST ETILMALTOLA V PLINIH PRI VISOKIH TLAKIH Mentor: izredni prof. dr. Mojca ŠKERGET Komentor: redni prof. dr. Željko KNEZ Kandidat: Lidija REPAS Maribor, oktober 2010
3
4 Fakulteta za kemijo in kemijsko tehnologijo Smetanova ulica 17, 2000 Maribor I Diplomsko delo visokošolskega strokovnega študijskega programa TOPNOST ETILMALTOLA V PLINIH PRI VISOKIH TLAKIH Študent: Študijski program: Smer: Predvideni strokovni naslov: Lidija REPAS visokošolski strokovni, Kemijska tehnologija Kemijska tehnologija dipl. inž. kem. tehnol. (VS) Mentor: Komentor: izredni prof. dr. Mojca ŠKERGET redni prof. dr. Željko KNEZ IZJAVA Izjavljam, da sem diplomsko delo izdelal(a) sam(a), prispevki drugih so posebej označeni. Pregledal(a) sem literaturo iz področja diplomskega dela po naslednjih elementih: Vir: NIST Chemistry WebBook Gesla: Supercritical fluids, ethylmaltol, propane, CO 2, ethanol, ethylmaltol, equilibrum, solubility Skupine gesel (unija itd.): Etilmaltol, topnost, propan, CO 2 Časovno obdobje: Od leta 2006 do leta 2010 Število referenc: 13 Število prebranih izvlečkov: 10 Število prebranih člankov: 5 Število pregledanih knjig: 7 Maribor, oktober podpis študenta (ke)
5 II ZAHVALA Zahvaljujem se prof. dr. Željku KNEZU in prof. dr. Mojci ŠKERGET za pomoč in nasvete pri opravljanju diplomske naloge. Prav tako se zahvaljujem osebju laboratorija za separacijske procese. Posebna zahvala velja mojim staršem, ki so mi omogočili študij ter moji sestri, ki mi je vedno stala ob strani in mi pomagala v najtežjih trenutkih. Zahvaljujem se tudi mojemu partnerju Frenku za vso njegovo izkazano podporo. Zahvaljujem pa se tudi vsem prijateljem, ki so me znali razveseliti, ko je bilo potrebno, ter Tini in Mateju za pomoč pri prevodih.
6 III TOPNOST ETILMALTOLA V PLINIH PRI VISOKIH TLAKIH Povzetek: S statično analitično metodo smo izmerili ravnotežne topnosti etilmaltola v ogljikovem dioksidu in propanu pri temperaturah 40, 60 in 80 C v območju tlakov od 30 do 250 bar. Analizo vzorcev smo opravili z UV-VIS spektrofotometrom z metodo umeritvenih krivulj. Rezultate smo podali v obliki tabel in grafov v odvisnosti molskega deleža od tlaka in temperature ter odvisnosti masnega deleža od gostote in temperature. Ključne besede: superkritični fluidi, etilmaltol, ravnotežna topnost, propan, CO 2 UDK: (043.2)
7 IV SOLUBILITY OF ETHYLMALTOL IN GASES AT HIGH PRESSURES Abstract: The equilibrum solubilities of ethylmaltol in carbon dioxide and propane were measured by a static-analytic method at temperatures 40, 60 and 80 C and in the pressure range from 30 to 250 bar. Analyses of samples were performed with UV-VIS spectrophotometer by using calibration curves. Results are given in form of tabels and graphs, presenting the dependence of the mole fraction on the pressure and the temperature and the dependence of the mass fraction on the density and the temperature. Keywords: supercritical fluids, ethylmaltol, equilibrium solubility, propane, CO 2 UDK: (043.2)
8 V KAZALO VSEBINE 1. UVOD 1 2. TEORETIČNI DEL ETILMALTOL ETANOL SUPERKRITIČNI FLUIDI TOPNOST SUBSTANC V SUPERKRITIČNIH FLUIDIH PROPAN Nevarnosti Lastnosti propana kot topila pri superkritičnih pogojih OGLJIKOV DIOKSID Fizikalne in kemijske lastnosti ogljikovega dioksida Lastnosti CO 2 kot topila pri superkritičnih pogojih EKSPERIMENTALNE METODE ZA MERJENJE TOPNOSTI V SUPERKRITIČNEM FLUIDU DINAMIČNA METODA STATIČNA ANALITIČNA METODA STATIČNA SINTETIČNA METODA SPEKTROFOTOMETRIČNA ANALIZNA METODA UV-VIS ABSORPCIJSKI SPEKTROFOTOMETER METODA UMERITVENE KRIVULJE 17
9 VI 3. EKSPERIMENTALNI DEL MATERIALI IZVEDBA MERITEV TOPNOSTI SUBSTANC V SUPERKRITIČNIH FLUIDIH ANALIZNA METODA ZA DOLOČEVANJE KONCENTRACIJE SUBSTANC IZRAČUN MASA TOPLJENCA V ODVZETEM VZORCU MASA SPROŠČENEGA SUPERKRITIČNEGA FLUIDA PRI VZORČENJU IZRAČUN RAVNOTEŽNE TOPNOSTI TOPLJENCA V ZGOŠČENEM PLINU REZULTATI UMERITVENA KRIVULJA ETILMALTOLA TOPNOST ETILMALTOLA V PROPANU TOPNOST ETILMALTOLA V CO RAZPRAVA ZAKLJUČEK REFERENCE 39
10 VII KAZALO SLIK Slika 2.1: Strukturna formula etilmaltola. 2 Slika 2.2: Etilmaltol. 3 Slika 2.3: Diagram tlak-temperatura za čisto snov. 5 Slika 2.4: Izoterme topnosti v odvisnosti od tlaka. 7 Slika 2.5: Strukturna formula propana. 8 Slika 2.6: ρ-t diagram za propan. 9 Slika 2.7: P-T diagram za CO 2 s premicami konstantne gostote. 12 Slika 3.1: Shema aparature za določitev topnosti substanc v superkritičnih fuidih. 19 Slika 4.1: Absorpcijski spekter za etilmaltol (topilo-etanol). 25 Slika 4.2: Umeritvena krivulja za etilmaltol (topilo-etanol) 25 Slika 4.3: Topnost etilmaltola v propanu (molski delež) v odvisnosti od tlaka in temperature. 27 Slika 4.4: Topnost etilmaltola v propanu (masni delež) v odvisnosti od gostote in temperature. 28 Slika 4.5: Topnost etilmaltola v CO 2 (molski delež) v odvisnosti od tlaka in temperature. 31 Slika 4.6: Topnost etilmaltola v CO 2 (masni delež) v odvisnosti od gostote in temperature. 31 Slika 4.7: Primerjava rezultatov topnosti etilmaltola v CO 2 (molski delež) v odvisnosti od tlaka in temperature pri 60 C. 32 Slika 4.8: Primerjava rezultatov topnosti etilmaltola v CO 2 (masni delež) v odvisnosti od gostote in temperature pri 60 C. 33 Slika 4.9: Topnost etilmaltola v CO 2 (molski delež) v odvisnosti od tlaka in temperature. 33 Slika 4.10: Topnost etilmaltola v CO 2 (masni delež) v odvisnosti od gostote in temperature. 34 Slika 5.1: Fazni prehod iz trdnega stanja v tekoče etilmaltola v propanu in v CO Slika 5.2: Primerjava topnosti etilmaltola v propanu in v CO 2 (molski delež) v odvisnosti od tlaka in temperature. 36 Slika 5.3: Primerjava topnosti etilmaltola v propanu in CO 2 (masni delež) v odvisnosti od gostote in temperature. 37
11 VIII KAZALO TABEL Tabela 2.1: Fizikalno-kemijske lastnosti propana. 2 Tabela 2.2: Red velikosti fizikalnih veličin za pline, SCF in tekočine. 6 Tabela 2.3: Fizikalno-kemijske lastnosti propana. 10 Tabela 2.4: Fizikalno-kemijske lastnosti CO Tabela 4.1: Topnost etilmaltola v propanu pri 40 C. 26 Tabela 4.2: Topnost etilmaltola v propanu pri 60 C. 26 Tabela 4.3: Topnost etilmaltola v propanu pri 80 C. 27 Tabela 4.4: Topnost etilmaltola v CO 2 pri 40 C 29 Tabela 4.5: Topnost etilmaltola v CO 2 pri 60 C 30 Tabela 4.6: Topnost etilmaltola v CO 2 pri 80 C 30 Tabela 4.7: Topnost etilmaltola v CO 2 pri 60 C ponovne meritve 32
12 IX UPORABLJENI SIMBOLI IN VELIČINE A absorbanca (nm) b dolžina poti svetlobe skozi raztopino (cm) c koncentracija (g/100g raztopine) (mol/l) D difuzijski koeficient (m 2 /s) h višina vodnega stolpca (m) k naklon premice umeritvene krivulje M molska masa (g/mol) m masa (kg) n množina (mol) n odsek na ordinati umeritvene krivulje P tlak (bar) P C kritični tlak (bar) P Z atmosferski tlak (bar) R splošna plinska konstanta (N m/mol K) T temperatura ( C) T C kritična temperatura ( C) V volumen (m 3 ) x molski delež (%) w masni delež (%) ε absorpcijski koeficient (L/mol cm) ρ gostota (kg/m 3 ) ρ C kritična gostota (kg/m 3 ) η viskoznost (kg/m s) ω acentrični faktor UPORALJENE KRATICE SFC superkritični fluid UV ultravijolično VIS vidna svetloba
13 Uvod 1 1. UVOD Etilmaltol (C 7 H 8 O 3 ) je pri sobni temperaturi nestrupen, trden, bel prah in je dobro topen v večini polarnih tekočin. Etilmaltol se tali pri temperaturi med C in ima temperaturo vrelišča pri 161 C. Ima sladek vonj, ki ga lahko opišemo kot karameliziran sladkor ali kuhano sadje. Etilmaltol je pomembna aroma v prehrambeni in parfumski industriji ter industriji pijač. Etilni sadni sladkor je nestrupen, zelo prijetnega vonja, katerega ljudje zelo hitro zaznamo [1]. Superkritični fluidi (SCF) so plini ali tekočine nad kritično točko. To so pogoji, ko sta tlak in temperatura nad kritičnima vrednostima [9]. Superkritični fluidi se uporabljajo kot topila za različne ekstrakcijske procese kot so dekofeinacija kave in čaja, ekstrakcija hmelja, začimb in eteričnih olj. V novejšem času se superkritični fluidi uporabljajo tudi v neekstrakcijskih procesih kot npr. topila za kemijske in biokemijske reakcije, topila za kromatografske postopke, mediji za pridobivanje majhnih delcev [9]. V prehrambeni industriji in ekstrakcijskih procesih se lahko brez omejitve uporabljajo naslednja topila: voda, propan, butan, butilacetat, etilacetat, etanol, CO 2, aceton in N 2 O. Predvsem CO 2 in propan sta zelo uporabna, saj imata ugodne fizikalno kemijske lastnosti in sta zdravju neškodljiva [9]. Značilni lastnosti superkritičnih fluidov sta po eni strani zelo velika stisljivost in gostota, ki je podobna gostoti tekočin, po drugi strani pa imajo podobne transportne sposobnosti kot plini [9]. V sistemu topljenec-superkritični fluid je topnost odvisna od narave in fizikalno-kemijskih lastnosti topljenca na eni strani in topila na drugi strani. Nanjo vpliva več dejavnikov. Med fizikalnimi sta najpomembnejša tlak in temperatura. Kvantitativne določitve topnosti različnih topljencev v zgoščenih plinih potrjujejo, da se topnost trdnih snovi in tekočin v superkritičnih plinih močno spreminja s tlakom in temperaturo [9]. Naš namen je bil določiti ravnotežne topnosti etilmaltola v superkritičnem ogljikovem dioksidu in propanu v odvisnosti od temperature in tlaka. Topnost etilmaltola v superkritičnih fluidih smo določevali s statistično analitično metodo.
14 Teoretični del 2 2. TEORETIČNI DEL 2.1 ETILMALTOL V tabeli 2.1 so prikazane fizikalno-kemijske lastnosti etilmaltola [1]. Tabela 2.1: Fizikalno-kemijske lastnosti propana [1]. LASTNOST VREDNOST Molekulska formula C 7 H 8 O 3 Molska masa Imena Fizikalne lastnosti 140,14 g/mol Etilmaltol; 2-etil-3hidroksi-4-piron Bel kristalen prah sladkobnega karamelnega vonja Temperatura tališča 90,44 C Temperatura vrelišča 161,00 C Topnost v vodi 1-2 (g/100g) Slika 2.1 prikazuje strukturno formulo etilmaltola [2]. Slika 2.1: Strukturna formula etilmaltola [2].
15 Teoretični del 3 Slika 2.2 prikazuje videz etilmaltola [3]. Slika 2.2: Etilmaltol [3].
16 Teoretični del ETANOL Etanol (tudi etilni alkohol) je alkohol, katerega formula je C 2 H 5 OH. Etanol je pri sobni temperaturi brezbarvna tekočina, večini prijetnega duha. Vsebujejo ga alkoholne pijače. V večjih količinah in koncentracijah je strupen. Uživanje etanola pri ljudeh povzroča kratkotrajne, včasih ugodne psihofizične odzive in zasvojenost [7]. Etanol je uporaben kot razkužilo, topilo in kot gorivo [7]. Etanol v naravi predelujejo glive kvasovke iz sladkorja z alkoholnim vrenjem, pridobivamo pa ga tudi v petrokemiji, iz naftnih derivatov, zlasti z oksidacijo etilena. Kvasovke pri večji koncentraciji etanola odmrejo, zato je neposredno z vrenjem možno doseči do največ 25% delež etanola. Večjo koncentracijo dobimo z destilacijo [7].
17 Teoretični del SUPERKRITIČNI FLUIDI Superkritični fluidi so plini ali tekočine nad kritično točko. To so pogoji, ko sta tlak in temperatura nad kritičnima vrednostima (T>T C, P>P C ) [9]. Subkritični fluidi so plini ali tekočine pri subkritičnih pogojih. To so pogoji, kjer je temperatura pod kritično vrednostjo, tlak pa je lahko nad ali pod kritičnim tlakom [13]. Topila pri superkritičnih pogojih združujejo ugodne lastnosti topil v tekočem stanju (gostota) in ugodne lastnosti v plinastem stanju (viskoznost) [9]. Slika 2.3 prikazuje P-T diagram za čisto snov [12]. Tri daljice delijo P-T diagram na tri področja: trdno, tekoče in plinasto. Na črtah sta dve fazi v ravnotežju, v trojni točki pa hkrati v ravnotežju obstajajo vse tri faze. Za vsako spojino obstaja kritična točka (T C, P C ), kjer se konča nekontinuirani prehod iz tekočega stanja v plin. Nad kritično točko je topilo v nadkritičnem (sinonim superkritičnem) stanju in ga opišemo kot superkritični fluid. V tem območju se termofizikalne lastnosti bistveno spreminjajo s tlakom in temperaturo [9]. Slika 2.3: Diagram tlak-temperatura za čisto snov [9]. Značilni lastnosti superkritičnih fluidov sta po eni strani velika stisljivost in gostota, ki je podobna gostoti tekočin, po drugi strani pa imajo podobne transportne lastnosti kot plini [9].
18 Teoretični del 6 Tabela 2.2 prikazuje velikostne rede nekaterih fizikalnih veličin za pline, tekočine in superkritične fluide [9]. Tabela 2.2: Red velikosti fizikalnih veličin za pline, SCF in tekočine [9]. Plin Superkritični fluid Tekočina gostota; ρ (kg/m 3 ) 1 0,3* difuzijski koeficient; D (m 2 /s) *10-10 viskoznost; η (kg/ms) Vidimo, da je gostota SCF reda velikosti gostote tekočin, medtem ko je njihova viskoznost podobna viskoznosti plinov. Difuzivnost je nižja od difuzivnosti plinov in višja od difuzivnosti tekočin. Zvišanje gostote fluida pogosto omogoča povečanje topnosti topljenca, medtem ko nizka viskoznost omogoča boljše transportne lastnosti. Lastnosti plina pri superkritičnih pogojih torej združujejo ugodne lastnosti topil v tekočem in plinastem stanju [9]. Osnovna lastnost SCF, ki predstavlja širok potencial v separacijskih procesih, je možnost spreminjanja gostote topila SCF v bližini njegove kritične točke z majhnimi spremembami temperature in/ali tlaka [9]. Superkritični fluidi se največkrat uporabljajo pri postopkih ekstrakcije v prehrambeni, kozmetični, farmacevtski in kemijski industriji. V zadnjem času superkritične fluide uporabljajo tudi za neekstrakcijske postopke, kot je visokotlačna mikronizacija in kot topilo v kemijskih in biokemijskih reakcijah [12] TOPNOST SUBSTANC V SUPERKRITIČNIH FLUIDIH V splošnem za topnost substanc v superkritičnih fluidih velja: 1. s povečanjem gostote pri konstanti temperaturi se poveča topnostna kapaciteta fluida, 2. s povišanjem temperature pri določeni gostoti se poveča topnost snovi v SCF [9]. Katero pravilo bo v specifičnem primeru prevladovalo ne moremo napovedati, zato je za določen primer potrebno eksperimentalno določiti topnost v odvisnosti od temperature in tlaka [9].
19 Teoretični del 7 Splošni potek topnostnih izoterm prikazuje slika 2.4 [12]. Z naraščanjem tlaka pri konstantni temperaturi narašča gostota topila. Razdalja med molekulami topila se manjša, s tem pa se povečajo specifične interakcije med molekulami topljenca in topila. Drugi faktor, ki vpliva na topnost je temperatura, ki vpliva na parni tlak topljenca in na gostoto topila. Pri nizkih tlakih (pod prehodnim območjem-slika 2.4) že z majhnim naraščanjem temperature gostota topila hitro pada. Vpliv gostote topila v tem območju prevladuje in zato topnost pada z naraščanjem temperature. Pri višjih tlakih je gostota topila le malo odvisna od temperature zato bo topnost naraščala zaradi naraščanja parnega tlaka komponente [11]. Slika 2.4: Izoterme topnosti v odvisnosti od tlaka [12] PROPAN Propan je brezbarven plin, tretji v homologni vrsti alkanov z molekulsko formulo C 3 H 8. Propan je sestavina nafte in zemeljskega plina [4]. Uporablja se predvsem kot gorivo za ogrevanje in pogon motorjev z notranjim zgorevanjem. Razlog za to je njegova visoka hlapnost, zaradi katere naprave ne potrebujejo posebnega uparilnika, ampak zadostuje primerna dozirna šoba. Drugi razlog je zmeren tlak, ki ga ima v utekočinjenem stanju. Zmeren tlak zmanjšuje tveganje zaradi eksplozije in poenostavi polnjenje jeklenk [4]. Molekulska formula: C 3 H 8 [4].
20 Teoretični del 8 Slika 2.5 prikazuje strukturno formulo propana [5]. Slika 2.5: Strukturna formula propana [5] NEVARNOSTI Utekočinjeni in plinasti propan sta zelo lahko vnetljiva in z zrakom tvorita eksplozivne zmesi. Propan je 1,5-krat gostejši od zraka, zato se zbira in širi pri tleh. Pri izparevanju tekočega propana v atmosfero nastajajo bele pare, ki so posledica kondenzacije zračne vlage. Pri nepopolnem zgorevanju lahko nastaja strupeni ogljikov monoksid [4]. Propan ni toksičen, pri zlorabah z inhaliranjem pa deluje zadušljivo zaradi pomanjkanja kisika. Komercialni propani lahko poleg propana vsebujejo tudi druge ogljikovodike, ki lahko povečajo tveganje. Propan se običajno skladišči pri povišanem tlaku pri sobni temperaturi. Pri ekspandiranju se plin močno ohladi in lahko povzroči blage ozebline [4]. Vdihavanje nizke koncentracije propana lahko ima narkotičen učinek. Simptomi zastrupitve so vrtoglavica, glavobol, bruhanje in izguba koordinacije. Visoke koncentracije lahko povzročijo zadušitve. Simptomi zadušitve so nezmožnost gibanja in nezavest [4].
21 Teoretični del LASTNOSTI PROPANA KOT TOPILA PRI SUPERKRITIČNIH POGOJIH Slika 2.6 prikazuje ρ-t diagram za propan [11]. Slika 2.6: ρ-t diagram za propan [11].
22 Teoretični del 10 V tabeli 2.3 so prikazane fizikalno-kemijske lastnosti propana [11]. Tabela 2.3: Fizikalno-kemijske lastnosti propana [11]. LASTNOST Molska masa; M VREDNOST 44,097 g/mol Kritična temperatura; T C 96,7 C Kritični tlak; P C 42,47 bar Kritična gostota; ρ C 220,5 kg/m 3 Trojna točka pri 16,9*10 bar -187,68 C Gostota plinske faze 2,03 kg/m 3 Gostota tekoče faze pri 0 C Vrelišče Tališče Vnetišče Temperatura samovžiga 0,52 kg/l -42,09 C -187,6 C -103,85 C 450,18 C Meja eksplozivnosti 2,0-10,0 vol % Topnost v vodi pri 20 C 70 g/l OGLJIKOV DIOKSID Ogljikov dioksid je pri standardnih pogojih plin s kemijsko formulo CO 2. V majhni količini (0,03 %) je navzoč v Zemljinem ozračju, kjer deluje kot toplogredni plin [6]. Ogljikov dioksid nastaja pri izgorevanju organskih snovi, če je na voljo zadostna količina kisika. Nastaja tudi pri celičnem dihanju, številni mikroorganizmi ga proizvajajo pri ferementaciji [6].
23 Teoretični del FIZIKALNE IN KEMIJSKE LASTNOSTI OGLJIKOVEGA DIOKSIDA Ogljikov dioksid je brezbarven plin, ki ob vdihavanju v visokih koncentracijah povzroči v ustih kisel okus, v nosu in grlu pa pekoč občutek. Oba pojava povzroča ogljikova kislina, ki nastaja ob raztapljanju ogljikovega dioksida v sluznici [6]. Molekula ogljikovega dioksida (O=C=O) vsebuje dve kovalentni vezi, je linearne oblike in nima električnega dipolnega momenta. Ker je povsem oksidirana, ogljikov dioksid ni zelo reaktiven in ni vnetljiv [6]. Pri temperaturi, nižji od -78 C in atmosferskem tlaku, ogljikov dioksid kondenzira v trdno snov bele barve, imenovano suhi led. V tekoči obliki obstaja le pri tlaku, večjem od 5,1 bar, pri atmosferskem tlaku pa v procesu, imenovanem sublimacija, preide neposredno iz trdne v plinasto fazo [6]. Ogljikov dioksid je dobro topen v vodi. Pri standardnih pogojih dana prostornina vode absorbira enako prostornino ogljikovega dioksida. Približno 1% raztopljenega ogljikovega dioksida se pri tem pretvori v ogljikovo kislino, ta pa nadalje delno disociira in tvori bikarbonatne in karbonatne ione [6] LASTNOSTI CO 2 KOT TOPILA PRI SUPERKRITIČNIH POGOJIH CO 2 je poceni, tudi z visoko stopnjo čistosti je na razpolago v velikih količinah in ima majhen vpliv na okolje. Nastaja iz naravnih virov, pri reakcijah zgorevanja ali kot stranski produkt pri drugih industrijskih procesih, od koder bi ga sicer morali odvajati v atmosfero. V majhnih koncentracijah je nestrupen, kemijsko inerten, nima vonja in ni vnetljiv. Po zmanjšanju tlaka se ga brez problemov vrne v plinsko stanje, njegovo odstranjevanje s substrata pa je enostavno zaradi njegovega visokega parnega tlaka. Z uporabo zaprtega zračnega sistema ga lahko obnovimo v obliki čistega plina in ga vračamo v proces [11]. Slika 2.7 prikazuje P-T diagram za CO 2 s premicami konstantne gostote [12]. Z minimalnimi spremembami tlaka in temperature v bližini kritične točke lahko dosežemo velike spremembe v gostoti in s tem različne topnosti snovi v CO 2 pri superkritičnih pogojih [11].
24 Teoretični del 12 Slika 2.7: P-T diagram za CO 2 s premicami konstantne gostote [12].
25 Teoretični del 13 V tabeli 2.4 so prikazane fizikalno-kemijske lastnosti CO 2 [11]. Tabela 2.4: Fizikalno-kemijske lastnosti CO 2 [11]. LASTNOST Molska masa; M VREDNOST 44,01 g/mol Kritična temperatura; T C 31,06 C Kritični tlak; P C 73,8 bar Kritična gostota; ρ C 468 kg/m 3 Trojna točka pri 5,17 bar -56,6 C Gostota pri 298 K 1,98 kg/m 3 Vrelišče Tališče Temperatura samovžiga -78,5 C -56,6 C 450,18 C Meja eksplozivnosti 2,0-10,0 vol % Topnost v vodi pri 25 C in 100 kpa 1,45 g/l Prednosti uporabe superkritičnega CO 2 kot topila pred uporabo drugih superkritičnih topil so: ne povzroča korozije, ni vnetljiv, ima sorazmerno nizko kritično temperaturo, nizka cena, dosegljivost v velikih količinah in z visoko čistoto, fiziološko neškodljiv, deluje bakteriocidno [11].
26 Teoretični del 14 Za topnost različnih snovi v superkitičnem CO 2 so določili naslednje zakonitosti: kisikove organske spojine z nizko ali srednjo molsko maso (ketoni, estri, alkoholi, ) so zelo dobro topne, večina napolarnih organskih substanc nizke molske mase (alkani, alkeni, terpeni, ) je prav tako dobro topnih, polarne organske kemikalije (karboksilne kisline) so topne, če nimajo previsoke molske mase, v homolognih vrstah se topnost običajno zmanjšuje z naraščajočo molsko maso, prisotnost polarnih skupin (karboksilne, hidroksilne ali nitro skupine) običajno zmanjšuje topnost spojin, maščobne kisline in njihovi gliceridi imajo nizko topnost [11].
27 Teoretični del EKSPERIMENTALNE METODE ZA MERJENJE TOPNOSTI V SUPERKRITIČNEM FLUIDU Metode za merjenje topnosti v superkritičnem fluidu so: dinamične; v primeru, ko tekoča ali trdna faza ostaja v ravnotežni celici, plin oz. SCF fluid pa teče skozi ravnotežno celico, statične; v primeru, ko ravnotežno celico z določenim volumnom napolnimo s topljencem in topilom [11] DINAMIČNA METODA Superkritični fluid teče po sistemu cevi skozi kopel s konstantno temperaturo tako, da doseže temperaturo kopeli še preden pride v stik s topljencem. Fluid počasi teče skozi kolono (običajno dve ali več kolon), kjer postane nasičen s topljencem. Nato ga ekspandiramo na atmosferski tlak, pri čemer topljenec izpade iz raztopine [11]. Prednosti dinamične metode: direktno vzorčevanje, relativno hitro dobimo veliko ponovljivih podatkov o topnosti [11]. Slabosti dinamične metode: možne so fazne spremembe v kolonah, trdna substanca lahko zamaši ventil, kar povzroči napake pri merjenju, vzorčujemo lahko samo lažjo fazo in zato ne moremo vedeti kakšna je topnost superkritičneg fluida v tekoči fazi, ravnotežne eksperimente z večkomponentnimi mešanicami moramo previdno načrtovati, da ne pride do izgube ene ali več komponent [11] STATIČNA ANALITIČNA METODA Ravnotežno celico napolnimo s substanco in superkritičnim fluidom. Pri konstantni temperaturi in tlaku heterogeno mešanico dobro premešamo. Po vzpostavitvi ravnotežja in ločitvi faz odvzamemo vzorec. Če je količina vzorca dovolj majhna v primerjavi z volumnom ravnotežne celice, lahko nadaljujemo z meritvami ravnotežja [11].
28 Teoretični del STATIČNA SINTETIČNA METODA Na začetku imamo heterogeno mešanico substance in ogljikovega dioksida. Nato spremenimo pogoje tako, da iz dvofaznega dobimo enofazni sistem, kar lahko dosežemo na več načinov: s kombinirano spremembo tlaka in temperature, s spremembo tlaka pri konstantni temperaturi ali s spremembo temperature pri konstantnem tlaku. Topnost substance v superkritičnem ogljikovem dioksidu dobimo iz množin obeh komponent s katerima smo napolnili ravnotežno celico. [11]
29 Teoretični del SPEKTROFOTOMETRIČNA ANALIZNA METODA UV-VIS ABSORPCIJSKI SPEKTROFOTOMETER Spektrofotometer sodi med relativne metode. Vzorec mora biti raztopljen v topilu, ki ne absorbira (ali minimalno) svetlobe tiste valovne dolžine, pri kateri merimo absorbanco vzorca. Količina vzorca, ki je potreben za analizo, je lahko več od 5 ml [10]. Vsak UV-VIS spektrofotometer je sestavljen iz: izvora svetlobe določene valovne dolžine, kivete, kamor nalijemo vzorec, detektorja, naprave, ki izpisuje rezultate. [10] METODA UMERITVENE KRIVULJE Kvantizacijo z umeritveno krivuljo uporabljamo vedno, kadar imamo večje število vzorcev, katerih koncentracije so v širšem razponu, včasih lahko tudi preko nekaj velikostnih redov. V ta namen si ponavadi pripravimo raztopine znanih koncentracij, ki pokrivajo ves interval pričakovanih koncentracij in ga v določeni meri še presegajo na obeh skrajnostih [10]. V diagram x-y, kjer je x-os koncentracija in y-os odziv, nanašamo ustrezne vrednosti, ki jih nato povežem z neprekinjeno črto. V idealnem primeru dobimo premico pod kotom 45 z izhodiščem v presečišču koordinatnih osi. V praksi ni nujno, da je dobljena odvisnost linearna, vendar je potrebno v takem primeru pripraviti več koncentracij standarda, da dobimo točke umeritvene krivulje dovolj na gosto. Normalno se zadovoljimo s 5-6 točkami v umeritveni krivulji [10]. V območju nizkih koncentracij velja za raztopine Beer Lambertov zakon [10]: A=ε b c (2.1) Kjer je: A absorbanca ε absorpcijski koeficient (L/mol cm) b dolžina poti svetlobe skozi raztopino; (cm) c koncentracija raztopine (mol/l)
30 Eksperimentalni del EKSPERIMENTALNI DEL 3.1 MATERIALI Uporabili smo naslednje substance: etilmaltol etanol, metanol, ogljikov dioksid propan.
31 Eksperimentalni del IZVEDBA MERITEV TOPNOSTI SUBSTANC V SUPERKRITIČNIH FLUIDIH Topnost etilmaltola v superkritičnem oglikovem dioksidu in propanu smo določili s statično analitično metodo. Slika 3.1 prikazuje shemo aparture za določitev topnosti substanc v superkritičnih pogojih[12]. varnostni ventil visokotlačna črpalka p T manometer termometer ventil rotameter visokotlačna celica vzorčna past oljna kopel magnetno mešalo z grelcem Slika 3.1: Shema aparature za določitev topnosti substanc v superkritičnih fuidih [12]n. Ravnotežno celico, volumna 125 ml, smo napolnili z 10 grami etilmaltola ter vanjo načrpali predhodno ohlajeni plin (CO 2 ali propan) iz jeklenke z visokotlačno črpalko (NWA PM-101). Tlak v ravnotežni celici smo kontrolirali z manometrom (Digibar PE 500 Hottinger-Baldwin). Temperaturo smo vzdrževali s pomočjo oljne kopeli in jo registrirali s pomočjo termometra v celici. Vsebino ravnotežne celice smo mešali eno uro z magnetnim mešalom pri konstantni temperaturi in tlaku. Po eni uri sedimentacije, da so se faze separirale, smo odvzeli vzorec (raztopino substance v superkritičnem CO 2 ali propanu) skozi ventil za vzorčevanje. Za ventilom je bila nameščena past (epruveta s topilom-etanol) v katero smo lovili substanco. Substanca se je v topilu raztopila. Količino substance smo določili z UVspektrofotometrom (VARIAN). Izmerili smo volumen sproščenega plina (plin smo lovili v merilni valj potopljen v vodo in mu tako z izpodrivanjem izmerili volumen).
32 Eksperimentalni del 20 Na osnovi predhodnih poizkusov sta bila določena čas mešanja in čas sedimentacije (1 ura). Optimalni čas mešanja se je določil tako, da se je vsebina ravnotežne celice mešala različno dolgo (0,5; 1; 2; 3 ure) in nato v vseh primerih, po enakem času sedimentacije (1 ura) vzel vzorec. Topnosti substanc so se minimalno razlikovale. Ravnotežje se je torej vzpostavilo že po eni uri. Optimalni čas sedimentacije pa se je določilo tako, da se je vsebina ravnotežne celice mešala eno uro pri različnem času sedimentacije (0,5; 1; 2; 3 ure). Nato se je vzel vzorec. Tudi tu so bile razlike v topnostih substance minimalne.
33 Eksperimentalni del ANALIZNA METODA ZA DOLOČEVANJE KONCENTRACIJE SUBSTANC Koncentracijo substance (etilmaltola) v etanolu smo določili z UV-spektrofotometrom. Absorbanco smo merili pri 280 nm. Umeritveno krivuljo za etilmaltol smo določili tako, da smo pripravili raztopine znanih koncentracij (v mg etilmaltola/100 g raztopine) in jim izmerili absorbanco. Meritve so pokazale, da je v območju nizkih koncentracij absorbanca linearna funkcija koncentracije, kar je v skladu z Beer-Lambertovim zakonom: A=ε l c (3.1) Kjer je: A absorbanca ε absorpcijski koeficient (g/mg. cm) l dolžina poti svetlobe v mediju (cm) c koncentracija (mg/g) Koncentracijo etimaltola v vzorcu smo izračunali tako, da smo izmerili absorbanco vzorca in uporabili enačbo premice umeritvene krivulje.
34 Eksperimentalni del IZRAČUN MASA TOPLJENCA V ODVZETEM VZORCU Vzorec smo iz ravnotežne celice odvzeli skozi ventil za vzorčenje. Za ventilom je bila nameščena past (epruveta s topilom-etanol) v katero smo lovili substanco. Substanca se je v topilu raztopila in gravimetrično smo določili maso raztopine (m r1 ): m ( g) m m r1 POL. EPRU. PRAZ. EPRU. = (3.2) Kjer je: m r1 masa raztopine (g) m POL. EPRU. masa polne epruvete (g) m PRAZ. EPRU. masa prazne epruvete (g) Nato smo vzorcu na UV-spektrofotometru izmerili absorbanco in s pomočjo enačbe premice umeritvene krivulje izračunali koncentracijo substance (etilmaltola) v g/100g raztopine. Indeks i določa etilmaltol: A = k c + n (3.3) r 1 i Iz dane enačbe izrazimo koncentracijo etil maltola in dobimo: A n r1 c ( g /100g) = (3.4) i k Kjer je: c i koncentracija etilmaltola (g/100 g) A r1 absorbanca raztopine n odsek na ordinati umeritvene krivulje k naklon premice umeritvene krivulje Maso etilmaltola v vzorcu odvzetem iz avtoklava, smo izračunali po enačbi: m c r1 i m ( g) = (3.5) i 100 Kjer je: m i masa etilmaltola (g) m r1 masa raztopine (g) c i koncentracija etilmaltola (g/100 g) V primeru, da je bila koncentracija etilmaltola previsoka (absorbanca izven mej umeritvene krivulje) smo vzorec razredčili. Enačba za izračun koncentracije etilmatola je dobila naslednjo obliko:
35 Eksperimentalni del 23 m i m m r1 rr i = (3.6) 100 mr c 2 Kjer je: m rr masa razredčene raztopine (g) m r2 masa osnovne raztopine v razredčeni raztopini(g) Nato lahko izračunamo število molov etilmaltola: n = m i ( mol) (3.7) i Mi Kjer je: m i masa etilmaltola v vzorcu iz avtoklava (g) M i molska masa etilmaltola (M EM =140,07 g/mol) n i množina etilmaltola (mol) MASA SPROŠČENEGA SUPERKRITIČNEGA FLUIDA PRI VZORČENJU Volumen superkritičnega fluida (ogljikovega dioksida oziroma propana) v odvzetem vzorcu smo izmerili z izpodrivanjem tekočine v graduiranem cilindru. Pri izračunu tlaka moramo zato upoštevati višino vodnega stolpca Tlak izračunamo po enačbi: P Z = P ρ g h (3.8) Kjer je: P Z atmosferski tlak (Pa) ρ...gostota vode (kg/m 3 ) h višina vodnega stolpca(m) g gravitacijski pospešek (m/s 2 ) Nato izračunamo število molov superkritičnega fluida (ogljikovega dioksida oziroma propana). Indeks j določa SCF (ogljikov dioksid oz. propan): P Vj n ( mol) = (3.9) j R T Kjer je: n j množina sproščenega superkritičnega fluida (mol) V j volumen sproščenega superkritičnega fluida (m 3 ) T temperatura vode v posodi pri jemanju vzorca (K)
36 Eksperimentalni del 24 R splošna plinska konstanta (J/mol K) P tlak (Pa) Izračunali smo še maso sproščenega ogljikovega dioksida oz. propana: m ( g) = n M (3.10) j j j Kjer je: M j molska masa SCF (M CO2 =44 g/mol oz. M C3H8 =44,03 g/mol) n j množina sproščenega superkritičnega fluida (mol) IZRAČUN RAVNOTEŽNE TOPNOSTI TOPLJENCA V ZGOŠČENEM PLINU Izračunali smo masni delež etilmaltola v odvzetem vzorcu: mi w (%) = 100 (3.11) i m + m i j Kjer je: m i masa etilmaltola (g) m j masa sproščenega superkritičnega fluida (g) in še molski delež etilmaltola: ni x = 100 (3.12) i n + n i j Kjer je: n i množina etilmaltola (mol) n j množina sproščenega superkritičnega fluida (mol)
37 Rezultati REZULTATI 4.1 UMERITVENA KRIVULJA ETILMALTOLA Slika 4.1 prikazuje absorpcijski spekter za etilmaltol (topilo-etanol). Slika 4.1: Absorpcijski spekter za etilmaltol (topilo-etanol). Slika 4.2 prikazuje umeritveno krivuljo za etilmaltol (topilo-etanol) umeritvena 1,2 A(absorbanca) 1 0,8 0,6 0,4 y = 519,66x - 0,0094 R 2 = 0,9999 0,2 0 0,0000 0,0005 0,0010 0,0015 0,0020 0,0025 c(g etilmaltola/100 g raztopine) Slika 4.2: Umeritvena krivulja za etilmaltol (topilo-etanol).
38 Rezultati TOPNOST ETILMALTOLA V PROPANU Ravnotežne topnosti etilmaltola smo izmerili pri temperaturah 40, 60 in 80 C v območju tlakov od ,5 bar. Rezultati meritev ravnotežnih topnosti etilmaltola so prikazani v tabelah od 4.1 do 4.3 ter na slikah 4.3 in 4.4. Tabela 4.1: Topnost etilmaltola v propanu pri 40 C. p SREDNJI (bar) ρ (kg/m 3 ) x EM (%) w EM (%) 29,0 475,04 0,038 0,122 53,0 480,12 0,065 0,206 83,5 490,79 0,086 0, ,5 499,80 0,101 0, ,5 500,86 0,161 0, ,5 509,12 0,118 0, ,5 512,65 0,098 0, ,5 516,53 0,073 0, ,5 518,48 0,039 0, ,0 523,27 0,015 0,049 Tabela 4.2: Topnost etilmaltola v propanu pri 60 C. p SREDNJI (bar) ρ (kg/m 3 ) x EM (%) w EM (%) 29,0 431,1 0,251 0,794 41,5 441,2 0,262 0,827 64,0 452,4 0,300 0,949 82,0 458,3 0,348 1,097 88,5 462,4 0,440 1, ,0 469,5 0,435 1, ,5 486,5 0,272 0, ,0 489,8 0,208 0, ,5 495,1 0,194 0, ,5 499,7 0,167 0,528
39 Rezultati 27 Tabela 4.3: Topnost etilmaltola v propanu pri 80 C. p SREDNJI (bar) ρ (kg/m 3 ) x EM (%) w EM (%) 33,5 378,1 0,296 0,934 39,5 388,0 0,324 1,022 49,0 399,4 0,348 1,100 59,0 408,7 0,372 1,173 73,5 419,4 0,495 1, ,0 437,2 0,408 1, ,5 453,1 0,321 1, ,0 459,9 0,309 0, ,5 472,2 0,292 0, ,0 474,5 0,267 0, ,5 476,5 0,248 0, ,5 481,8 0,230 0,728 0,60 0,50 0,40 T = 40 C T = 60 C T = 80 C x EM (%) 0,30 0,20 0,10 0, p SREDNJI (bar) Slika 4.3: Topnost etilmaltola v propanu (molski delež) v odvisnosti od tlaka in temperature.
40 Rezultati 28 1,80 1,60 1,40 1,20 T = 40 C T = 60 C T = 80 C w EM (%) 1,00 0,80 0,60 0,40 0,20 0, ρ (kg/m 3 ) Slika 4.4: Topnost etilmaltola v propanu (masni delež) v odvisnosti od gostote in temperature. Sliki 4.3 in 4.4 prikazujeta topnost etilmaltola v propanu. Topnosti smo izmerili v območju od 29,0 do 252,5 bar in temperaturah 40, 60, 80 C. Gostota se giblje v območju od 378,1 do 523,27 kg/m 3. Molski delež etilmaltola v propanu je v območju od 0,015 % pri 40 C in 29,0 bar do 0,495 % pri 80 C in 252,5 bar. Masni delež je v območju od 0,049 % pri 40 C in 29,0 bar do 1,558 % pri 80 C in 252,5 bar. Iz slike 4.3 je razvidno, da topnost pri konstantni temperaturi z naraščanjem tlaka naraste in doseže največjo vrednost pri 80 C in 73,5 bar in z nadaljnjim naraščanjem tlaka pada. Podoben potek imata tudi izotermi pri 60 in 40 C, kjer se maksimumi nahajajo pri 60 C oz. 88,5 bar ter pri 40 C oz. 124,5 bar. Enako velja za gostoto, kar je razvidno iz slike 4.4. Topnost pri konstantnem tlaku narašča s temperaturo od 40 C do 60 C, nato pa se z naraščanjem temperature do 80 C ne spreminja več bistveno.
41 Rezultati TOPNOST ETILMALTOLA V CO 2 Ravnotežne topnosti etilmaltola v CO 2 so že bile eksperimentalno določene v okviru predhodne diplomske naloge (Urška Vabel, 2007). Ker je bilo odstopanje meritev za ta sistem veliko, smo meritve pri 60 C ponovili. Rezultati meritev ravnotežnih topnosti etilmaltola pri temperaturah 40, 60 in 80 C (vse meritve), so prikazani v tabelah od 4.4 do 4.6 in na slikah 4.5 in 4.6. Tabela 4.4: Topnost etilmaltola v CO 2 pri 40 C. p SREDNJI (bar) ρ (kg/m 3 ) x EM (%) w EM (%) 95,5 580,7 0,059 0, ,5 677,1 0,106 0, ,5 699,9 0,359 1, ,0 763,5 0,498 1, ,0 815,5 0,442 1, ,5 825,3 0,394 1, ,0 848,8 0,494 1, ,5 861,1 0,300 0, ,0 867,9 0,208 0, ,0 895,0 0,085 0,270
42 Rezultati 30 Tabela 4.5: Topnost etilmaltola v CO 2 pri 60 C. p SREDNJI (bar) ρ (kg/m 3 ) x EM (%) w EM (%) 106,5 329,0 0,065 0, ,5 350,5 0,081 0, ,5 472,9 0,259 0, ,5 581,3 0,569 1, ,5 589,8 0,641 2, ,5 605,5 0,201 0, ,5 635,8 0,302 0, ,0 663,8 0,791 2, ,0 689,3 0,782 2, ,5 693,5 0,987 3, ,0 688,2 0,326 1, ,5 697,5 1,173 3, ,0 726,0 0,168 0, ,5 713,1 0,944 2, ,5 732,3 1,174 3, ,5 747,8 0,189 0, ,5 771,9 0,180 0, ,5 777,8 0,141 0, ,5 785,4 1,608 4, ,5 800,7 1,349 4, ,0 815,7 1,237 3,833 Tabela 4.6: Topnost etilmaltola v CO 2 pri 80 C. p SREDNJI (bar) ρ (kg/m 3 ) x EM (%) w EM (%) 111,5 264,1 0,050 0, ,5 275,9 0,069 0, ,5 339,2 0,258 0, ,5 334,0 0,252 0, ,5 430,2 0,423 1, ,5 438,9 0,448 1, ,5 484,4 0,689 2, ,0 507,0 0,843 2, ,5 571,9 0,822 2, ,0 596,4 0,685 2, ,0 613,0 0,609 1, ,0 639,3 0,516 1, ,5 658,0 0,290 0, ,0 669,3 0,273 0,865
43 Rezultati 31 1,80 1,60 1,40 1,20 T = 40 C T = 60 C T = 80 C x EM (%) 1,00 0,80 0,60 0,40 0,20 0, p SREDNJI (bar) Slika 4.5: Topnost etilmaltola v CO 2 (molski delež) v odvisnosti od tlaka in temperature. 6,0 w EM (%) 5,0 4,0 3,0 T = 40 C T = 60 C T = 80 C 2,0 1,0 0, ρ (kg/m 3 ) Slika 4.6: Topnost etilmaltola v CO 2 (masni delež) v odvisnosti od gostote in temperature.
44 Rezultati 32 Ker ima izoterma pri 60 C nenavaden potek, smo meritve pri 60 C ponovili in dobili rezultate podane v tabeli 4.7 in sliki 4.7. Tabela 4.7: Topnost etilmaltola v CO 2 pri 60 C ponovne meritve. p SREDNJI (bar) ρ (kg/m 3 ) x EM (%) w EM (%) 31,5 57,1 0,004 0,013 52,5 103,3 0,004 0,011 74,5 169,3 0,015 0,047 92,5 244,1 0,066 0, ,5 384,2 0,146 0, ,0 511,5 0,265 0, ,5 497,3 0,341 1, ,5 655,2 0,394 1, ,0 715,5 0,396 1, ,5 735,3 0,439 1, ,5 757,6 0,190 0, ,5 783,0 0,182 0, ,5 785,0 0,133 0,422 1,80 1,60 1,40 1,20 T = 60 C T = 60 C (2) x EM (%) 1,00 0,80 0,60 0,40 0,20 0, p SREDNJI (bar) Slika 4.7: Primerjava rezultatov topnosti etilmaltola v CO 2 (molski delež) v odvisnosti od tlaka in temperature pri 60 C.
45 Rezultati 33 6,00 5,00 4,00 T = 60 C T = 60 C (2) w EM (%) 3,00 2,00 1,00 0, ρ (kg/m 3 ) Slika 4.8: Primerjava rezultatov topnosti etilmaltola v CO 2 (masni delež) v odvisnosti od gostote in temperature pri 60 C. Iz slike 4.7 in 4.8 je razvidno, da so ponovljeni rezultati pri 60 C bolj natančni in jih bomo uporabili v nadaljnji razpravi. 0,90 0,80 0,70 0,60 T = 40 C T = 60 C (2) T = 80 C x EM (%) 0,50 0,40 0,30 0,20 0,10 0, p SREDNJI (bar) Slika 4.9: Topnost etilmaltola v CO 2 (molski delež) v odvisnosti od tlaka in temperature.
46 Rezultati 34 3,0 w EM (%) 2,5 2,0 1,5 T = 40 C T = 60 C (2) T = 80 C 1,0 0,5 0, ρ (kg/m 3 ) Slika 4.10: Topnost etilmaltola v CO 2 (masni delež) v odvisnosti od gostote in temperature. Sliki 4.9 in 4.10 prikazujeta topnost etilmaltola v ogljikovem dioksidu. Topnosti smo izmerili v območju od 31,5 do 273,0 bar pri temperaturah 40, 60, 80 C. Gostota se giblje v območju od 75,1 do 895,0 kg/m 3. Molski delež etilmaltola v ogljikovem dioksidu je v območju od 0,004 % pri 60 C in 31,5 bar do 0,822 % pri 80 C in 273,0 bar. Masni delež etilmaltola v ogljikovem dioksidu je v območju od 0,011 % pri 60 C in 31,5 bar do 2,636 % pri 80 C in 273,0 bar. Iz slike 4.9 je razvidno, da topnost pri konstantni temperaturi z naraščanjem tlaka naraste in doseže največjo vrednost pri 80 C in 168,0 bar ter z nadaljnjim naraščanjem tlaka pada. Podoben potek imata tudi izotermi pri 60 C in 40 C, kjer se maksimumi nahajajo pri 60 C oz. 195,0 bar ter pri 40 C oz. 144,0 bar. Enako velja za gostoto, kar je razvidno iz slike Topnost pri konstantnem tlaku se z naraščanjem temperature od 40 C do 60 C ne spreminja bistveno, nato pa z naraščanjem temperature od 60 C do 80 C naraste.
47 Razprava RAZPRAVA Fazni prehod iz trdnega stanja v tekoče za etilmaltol v plinu propanu in CO 2 je predstavljen na sliki 5.1 [12]. Iz slike 5.1 ja razvidno, da se tališče etilmaltola z naraščanjem tlaka bolj zniža, če je prisoten CO 2, kot pa, če je prisoten propan EM-CO2 EM-propane P (bar) T ( C) Slika 5.1: Fazni prehod iz trdnega stanja v tekoče etilmaltola v propanu in v CO 2 Etilmaltol ima pri atmosferskem tlaku tališče pri 90,44 C, ki se v prisotnosti CO 2 znižuje z naraščanjem tlaka do 150 bar, kjer je tališče pri 68 C. Z nadaljnjim naraščanjem tlaka je temperatura tališča konstantna. V prisotnosti propana tališče pade na 82 C pri 50 bar in je konstantno z naraščanjem tlaka. Topnost etilmaltola v propanu Izotermi (slika 4.1) pri 40 C in 60 C predstavljata ravnotežje med trdnim etilmaltolom in propanom. Izoterma pri 80 C se nahaja blizu trifazne črte SLV (slika 5.1) in lahko sklepamo, da se je etilmaltol pričel taliti.
48 Razprava 36 Topnost etilmaltola v CO 2 Izoterma (slika 4.9) pri 40 C prikazuje ravnotežje med trdnim etilmaltolom in CO 2. izoterma pri 60 C se nahaja blizu trifazne črte SLV in lahko sklepamo, da se je etilmaltol pričel taliti. Izoterma pri 80 C prikazuje ravnotežje tekočega etilmaltola v CO 2, kar vpliva na topnost, saj tukaj topnost narašča bolj strmo kot pri 40 in 60 C. Slika 5.2 prikazuje primerjavo topnosti etilmaltola v propanu in v ogljikovem dioksidu (molski delež) v odvisnosti od tlaka in temperature. x EM (%) 0,90 0,80 0,70 0,60 0,50 0,40 T = 40 C-propan T = 40 C-CO2 T = 60 C-propan T = 60 C-CO2 T = 80 C-propan T = 80 C-CO2 0,30 0,20 0,10 0, p SREDNJI (bar) Slika 5.2: Primerjava topnosti etilmaltola v propanu in v CO 2 (molski delež) v odvisnosti od tlaka in temperature
49 Razprava 37 Slika 5.3 prikazuje primerjavo topnosti etilmaltola v propanu in ogljikovem dioksidu (masni delež) v odvisnosti od gostote in temperature. 2,80 w EM (%) 2,40 2,00 1,60 1,20 T = 40 C-propan T = 40 C-CO2 T = 60 C-propan T = 60 C-CO2 T = 80 C-propan T = 80 C-CO2 0,80 0,40 0, ρ (kg/m 3 ) Slika 5.3: Primerjava topnosti etilmaltola v propanu in CO 2 (masni delež) v odvisnosti od gostote in temperature Po primerjanju topnosti je raziskava pokazala, da je topnost etilmaltola v propanu nekoliko večja kot v CO 2. Če pogledamo izoterme naših vzorcev, ugotovimo, da topnost narašča s padajočim vrstnim redom temperature tališča etilmaltola, kar pomeni, da nižja kot je temperatura tališča, višja je topnost.
50 Zaključek ZAKLJUČEK Določili smo topnosti etilmaltola v propanu in v ogljikovem dioksidu. Podatki iz literature kažejo, da se prične etilmaltol v ogljikovem dioksidu taliti pri nižji temperaturi, kot v propanu in sicer etilmaltol preide v ogljikovem dioksidu v tekoče stanje pri 68 C oz. 150 bar med tem, ko v propanu pri 82 C in 50 bar. Ugotovili smo, da če pride do faznega prehoda S-L substance v plinu, to vpliva na potek topnostnih izomer. Opazili smo tudi, da so topnostne izoterme bolje predstavljene v diagramih v odvisnosti od gostote topila, kot v diagramih v odvisnosti od tlaka, saj je z gostoto topila bolje predstavljena moč topila (z gostoto topila narašča moč topila). Tališče etilmaltola pri atmosferskem tlaku je 90,44 C in zato pride pri temperaturah, pri katerih smo izvajali meritve, do faznega prehoda etilmaltola. Pri 40 C imamo ravnotežje med trdnim etilmaltolom in propanom ter ravnotežje med trdnim etilmaltolom in CO 2. Pri 60 C se izoterma etilmaltola v propanu nahaja blizu fazne črt SLV, zato lahko sklepamo, da se je etilmaltol v propanu začel taliti, medtem ko predstavlja izoterma v CO 2 še vedno ravnotežje med trdnim etilmaltolom in CO 2. Pri 80 C imamo ravnotežje med tekočim etilmaltolom in propanom, medtem ko se izoterma etilmaltola v CO 2 nahaja blizu fazne črte SLV in se je etilmaltol šele začel taliti. Iz tega lahko sklepamo, da je propan boljše topilo za etilmaltol, saj se le ta prične prej raztapljat v propanu kot pa v CO 2.
51 Reference REFERENCE [1] MALTOL.htm [2] [3] [4] [5] ukt_izom_alkan.pdf [6] [7] [8] [9] Ž. Knez, M. Škerget, Termodifuzijski separacijski procesi. Maribor: Univerza v Mariboru, Fakulteta za kemijo in kemijsko tehnologijo, 1999, str [10] Krainer, M. Osnove za načrtovanje postopka separacije tokoferoli/maščobne kisline s superkritičnimi fluidi. Diplomsko delo. Maribor: univerza v Mariboru, Fakulteta za kemijo in kemijsko tehnologijo, [11] N. Dreca, Topnost vitaminov D 2 in E v CO 2 in propanu, Diplomsko delo, Fakulteta za kemijo in kemijsko tehnologijo, 2000 [12] U. Vabel, Ravnotežne topnosti maltolov v zgoščenih plinih, Diplomsko delo. Maribor: univerza v Mariboru, Fakulteta za kemijo in kemijsko tehnologijo, 2007 [13] P. Kotnik, Visokotlačna separacija biološko aktivnih komponent iz rastlinskih materialov. Magistrsko delo. Maribor: univerza v Mariboru, Fakulteta za kemijo in kemijsko tehnologijo, 2003
TOPLJENEC ASOCIIRA LE V VODNI FAZI
 TOPLJENEC ASOCIIRA LE V VODNI FAZI V primeru asociacij molekul topljenca v vodni ali organski fazi eksperimentalno določeni navidezni porazdelitveni koeficient (P n ) v odvisnosti od koncentracije ni konstanten.
TOPLJENEC ASOCIIRA LE V VODNI FAZI V primeru asociacij molekul topljenca v vodni ali organski fazi eksperimentalno določeni navidezni porazdelitveni koeficient (P n ) v odvisnosti od koncentracije ni konstanten.
ENAČBA STANJA VODE IN VODNE PARE
 ENAČBA STANJA VODE IN VODNE PARE SEMINARSKA NALOGA PRI PREDMETU JEDRSKA TEHNIKA IN ENERGETIKA TAMARA STOJANOV MENTOR: IZRED. PROF. DR. IZTOK TISELJ NOVEMBER 2011 Enačba stanja idealni plin: pv = RT p tlak,
ENAČBA STANJA VODE IN VODNE PARE SEMINARSKA NALOGA PRI PREDMETU JEDRSKA TEHNIKA IN ENERGETIKA TAMARA STOJANOV MENTOR: IZRED. PROF. DR. IZTOK TISELJ NOVEMBER 2011 Enačba stanja idealni plin: pv = RT p tlak,
METODE ZA PREDVIDEVANJE (NAPOVEDOVANJE) VODOTOPNOSTI (topnosti spojin v vodi)
 METODE ZA PREDVIDEVANJE (NAPOVEDOVANJE) VODOTOPNOSTI (topnosti spojin v vodi) Delitev metod (metode temeljijo na): 1. Prispevki posameznih skupin v molekuli k aktivnostnemu koeficientu spojine v vodi.
METODE ZA PREDVIDEVANJE (NAPOVEDOVANJE) VODOTOPNOSTI (topnosti spojin v vodi) Delitev metod (metode temeljijo na): 1. Prispevki posameznih skupin v molekuli k aktivnostnemu koeficientu spojine v vodi.
UNIVERZA V LJUBLJANI PEDAGOŠKA FAKULTETA INES HORVAT FIZIKALNO KEMIJSKE LASTNOSTI VODNIH RAZTOPIN DECILTRIMETILAMONIJEVEGA DEKANOATA DIPLOMSKO DELO
 UNIVERZA V LJUBLJANI PEDAGOŠKA FAKULTETA INES HORVAT FIZIKALNO KEMIJSKE LASTNOSTI VODNIH RAZTOPIN DECILTRIMETILAMONIJEVEGA DEKANOATA DIPLOMSKO DELO LJUBLJANA, 2017 UNIVERZA V LJUBLJANI PEDAGOŠKA FAKULTETA
UNIVERZA V LJUBLJANI PEDAGOŠKA FAKULTETA INES HORVAT FIZIKALNO KEMIJSKE LASTNOSTI VODNIH RAZTOPIN DECILTRIMETILAMONIJEVEGA DEKANOATA DIPLOMSKO DELO LJUBLJANA, 2017 UNIVERZA V LJUBLJANI PEDAGOŠKA FAKULTETA
FORMULACIJA IN KARAKTERIZACIJA NARAVNIH POLIMERNIH NOSILCEV ZA VEZAVO PIGMENTOV
 Tina Perko FORMULACIJA IN KARAKTERIZACIJA NARAVNIH POLIMERNIH NOSILCEV ZA VEZAVO PIGMENTOV Doktorska disertacija Maribor, oktober 2014 Formulacija in karakterizacija naravnih polimernih nosilcev za vezavo
Tina Perko FORMULACIJA IN KARAKTERIZACIJA NARAVNIH POLIMERNIH NOSILCEV ZA VEZAVO PIGMENTOV Doktorska disertacija Maribor, oktober 2014 Formulacija in karakterizacija naravnih polimernih nosilcev za vezavo
b) Računske naloge (z osnovami): 1. Izračunaj in nariši tiracijsko krivuljo, če k 10,0mL 0,126M HCl dodajaš deleže (glej tabelo) 0,126M NaOH!
 11. Vaja: Kemijsko ravnotežje II a) Naloga: 1. Izmeri ph destilirane in vodovodne vode, ter razloži njegovo vrednost s pomočjo eksperimentov!. Opazuj vpliv temperature na kemijsko ravnotežje!. Določi karbonatno
11. Vaja: Kemijsko ravnotežje II a) Naloga: 1. Izmeri ph destilirane in vodovodne vode, ter razloži njegovo vrednost s pomočjo eksperimentov!. Opazuj vpliv temperature na kemijsko ravnotežje!. Določi karbonatno
Stehiometrija za študente veterine
 Univerza v Ljubljani Veterinarska fakulteta Stehiometrija za študente veterine Učbenik s praktičnimi primeri za predmet Biokemija Nova, dopolnjena izdaja Petra Zrimšek Ljubljana, 016 Petra Zrimšek Stehiometrija
Univerza v Ljubljani Veterinarska fakulteta Stehiometrija za študente veterine Učbenik s praktičnimi primeri za predmet Biokemija Nova, dopolnjena izdaja Petra Zrimšek Ljubljana, 016 Petra Zrimšek Stehiometrija
Attempt to prepare seasonal weather outlook for Slovenia
 Attempt to prepare seasonal weather outlook for Slovenia Main available sources (ECMWF, EUROSIP, IRI, CPC.NCEP.NOAA,..) Two parameters (T and RR anomally) Textual information ( Met Office like ) Issued
Attempt to prepare seasonal weather outlook for Slovenia Main available sources (ECMWF, EUROSIP, IRI, CPC.NCEP.NOAA,..) Two parameters (T and RR anomally) Textual information ( Met Office like ) Issued
IZRAČUN MEMBRANSKE RAZTEZNE POSODE - "MRP" za HLADNOVODNE SISTEME (DIN 4807/2)
 IZPIS IZRAČUN MEMBRANSKE RAZTEZNE POSODE - "MRP" za HLADNOVODNE SISTEME Izhodiščni podatki: Objkt : Vrtc Kamnitnik Projkt : PZI Uporaba MRP : Črpalna vrtina Datum : 30.8.2017 Obdlal : Zupan Skupna hladilna
IZPIS IZRAČUN MEMBRANSKE RAZTEZNE POSODE - "MRP" za HLADNOVODNE SISTEME Izhodiščni podatki: Objkt : Vrtc Kamnitnik Projkt : PZI Uporaba MRP : Črpalna vrtina Datum : 30.8.2017 Obdlal : Zupan Skupna hladilna
ENERGY AND MASS SPECTROSCOPY OF IONS AND NEUTRALS IN COLD PLASMA
 UDK621.3:(53+54+621 +66), ISSN0352-9045 Informaclje MIDEM 3~(~UU8)4, Ljubljana ENERGY AND MASS SPECTROSCOPY OF IONS AND NEUTRALS IN COLD PLASMA Marijan Macek 1,2* Miha Cekada 2 1 University of Ljubljana,
UDK621.3:(53+54+621 +66), ISSN0352-9045 Informaclje MIDEM 3~(~UU8)4, Ljubljana ENERGY AND MASS SPECTROSCOPY OF IONS AND NEUTRALS IN COLD PLASMA Marijan Macek 1,2* Miha Cekada 2 1 University of Ljubljana,
OA07 ANNEX 4: SCOPE OF ACCREDITATION IN CALIBRATION
 OA07 ANNEX 4: SCOPE OF ACCREDITATION IN CALIBRATION Table of contents 1 TECHNICAL FIELDS... 2 2 PRESENTING THE SCOPE OF A CALIBRATION LABOORATORY... 2 3 CONSIDERING CHANGES TO SCOPES... 6 4 CHANGES WITH
OA07 ANNEX 4: SCOPE OF ACCREDITATION IN CALIBRATION Table of contents 1 TECHNICAL FIELDS... 2 2 PRESENTING THE SCOPE OF A CALIBRATION LABOORATORY... 2 3 CONSIDERING CHANGES TO SCOPES... 6 4 CHANGES WITH
MICROWAVE PLASMAS AT ATMOSPHERIC PRESSURE: NEW THEORETICAL DEVELOPMENTS AND APPLICATIONS IN SURFACE SCIENCE
 UDK621.3:(53+54+621 +66), ISSN0352-9045 Informacije MIDEM 38(2008)4, Ljubljana MICROWAVE PLASMAS AT ATMOSPHERIC PRESSURE: NEW THEORETICAL DEVELOPMENTS AND APPLICATIONS IN SURFACE SCIENCE T. 8elmonte*,
UDK621.3:(53+54+621 +66), ISSN0352-9045 Informacije MIDEM 38(2008)4, Ljubljana MICROWAVE PLASMAS AT ATMOSPHERIC PRESSURE: NEW THEORETICAL DEVELOPMENTS AND APPLICATIONS IN SURFACE SCIENCE T. 8elmonte*,
2A skupina zemeljskoalkalijske kovine
 1. NALOGA: V ČEM SE RAZLIKUJETA BeO IN MgO? 1. NALOGA: ODGOVOR Elementi 2. periode (od Li do F) se po fizikalnih in kemijskih lastnostih (diagonalne lastnosti) znatno razlikujejo od elementov, ki so v
1. NALOGA: V ČEM SE RAZLIKUJETA BeO IN MgO? 1. NALOGA: ODGOVOR Elementi 2. periode (od Li do F) se po fizikalnih in kemijskih lastnostih (diagonalne lastnosti) znatno razlikujejo od elementov, ki so v
Penjenje temnega piva
 Oddelek za fiziko Seminar I a - 1. letnik, II stopnja Penjenje temnega piva Avtor: Tilen Brecelj Mentor: prof. dr. Rudolf Podgornik Ljubljana, november 2012 Povzetek Seminar opisuje penjenej temnega piva,
Oddelek za fiziko Seminar I a - 1. letnik, II stopnja Penjenje temnega piva Avtor: Tilen Brecelj Mentor: prof. dr. Rudolf Podgornik Ljubljana, november 2012 Povzetek Seminar opisuje penjenej temnega piva,
ENHANCEMENT OF MOLECULAR WEIGHT OF L-LACTIC ACID POLYCONDENSATES UNDER VACUUM IN SOLID STATE
 UDK 678.7 ISSN 1580-2949 Original scientific article/izvirni znanstveni ~lanek MTAEC9, 46(1)37(2012) ENHANCEMENT OF MOLECULAR WEIGHT OF L-LACTIC ACID POLYCONDENSATES UNDER VACUUM IN SOLID STATE POVE^ANJE
UDK 678.7 ISSN 1580-2949 Original scientific article/izvirni znanstveni ~lanek MTAEC9, 46(1)37(2012) ENHANCEMENT OF MOLECULAR WEIGHT OF L-LACTIC ACID POLYCONDENSATES UNDER VACUUM IN SOLID STATE POVE^ANJE
TOPILO IZSTOPNI VENTIL CILINDER KOLONA DUŠILEC
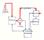 TOPILO VSTOPNI VENTIL CILINDER BAT IZSTOPNI VENTIL KOLONA DUŠILEC HPLC: 1. PORAZDELITVENA ( liquid-liquid ) 2. IONSKA 3. IZKLJUČITVENA oziroma GELSKA 4. ADSORPCIJSKA oziroma LIQUID-SOLID majhni delci (
TOPILO VSTOPNI VENTIL CILINDER BAT IZSTOPNI VENTIL KOLONA DUŠILEC HPLC: 1. PORAZDELITVENA ( liquid-liquid ) 2. IONSKA 3. IZKLJUČITVENA oziroma GELSKA 4. ADSORPCIJSKA oziroma LIQUID-SOLID majhni delci (
1 Ternik Primož - Zasebni raziskovalec, Bresterniška ulica 163, Bresternica
 Izvirni znanstveni članek TEHNIKA numerične metode Datum prejema: 14. november 2016 ANALI PAZU 6/ 2016/ 1-2: 14-19 www.anali-pazu.si Evaporation of water droplets in the 1st stage of the ultrasonic spray
Izvirni znanstveni članek TEHNIKA numerične metode Datum prejema: 14. november 2016 ANALI PAZU 6/ 2016/ 1-2: 14-19 www.anali-pazu.si Evaporation of water droplets in the 1st stage of the ultrasonic spray
Saponification Reaction System: a Detailed Mass Transfer Coefficient Determination
 DOI: 10.17344/acsi.2014.1110 Acta Chim. Slov. 2015, 62, 237 241 237 Short communication Saponification Reaction System: a Detailed Mass Transfer Coefficient Determination Darja Pe~ar* and Andreja Gor{ek
DOI: 10.17344/acsi.2014.1110 Acta Chim. Slov. 2015, 62, 237 241 237 Short communication Saponification Reaction System: a Detailed Mass Transfer Coefficient Determination Darja Pe~ar* and Andreja Gor{ek
Pojav, da se en element pojavlja v dveh ali več oblikah, ki imajo različno zgradbo, se imenuje alotropija.
 ELEMENT, SPOJINA Element je snov, ki je s kemijsko reakcijo ni mogoče razstaviti v še enostavnejše snovi (R. Boyle l. 1661). Na in Cl 2 sta elementa, NaCl pa je spojina. Elementi so lahko pri sobnih pogojih
ELEMENT, SPOJINA Element je snov, ki je s kemijsko reakcijo ni mogoče razstaviti v še enostavnejše snovi (R. Boyle l. 1661). Na in Cl 2 sta elementa, NaCl pa je spojina. Elementi so lahko pri sobnih pogojih
UNIVERZA V MARIBORU FAKULTETA ZA KEMIJO IN KEMIJSKO TEHNOLOGIJO. Simonič Marjana TEHNOLOGIJA VOD. Laboratorijske vaje
 UNIVERZA V MARIBORU FAKULTETA ZA KEMIJO IN KEMIJSKO TEHNOLOGIJO Simonič Marjana TEHNOLOGIJA VOD Laboratorijske vaje Maribor, Februar 2004 DOLOČITEV OBARVANOSTI IN MOTNOSTI 1. Namen Določimo obarvanost
UNIVERZA V MARIBORU FAKULTETA ZA KEMIJO IN KEMIJSKO TEHNOLOGIJO Simonič Marjana TEHNOLOGIJA VOD Laboratorijske vaje Maribor, Februar 2004 DOLOČITEV OBARVANOSTI IN MOTNOSTI 1. Namen Določimo obarvanost
OPTIMIRANJE IZDELOVALNIH PROCESOV
 OPTIMIRANJE IZDELOVALNIH PROCESOV asist. Damir GRGURAŠ, mag. inž. str izr. prof. dr. Davorin KRAMAR damir.grguras@fs.uni-lj.si Namen vaje: Ugotoviti/določiti optimalne parametre pri struženju za dosego
OPTIMIRANJE IZDELOVALNIH PROCESOV asist. Damir GRGURAŠ, mag. inž. str izr. prof. dr. Davorin KRAMAR damir.grguras@fs.uni-lj.si Namen vaje: Ugotoviti/določiti optimalne parametre pri struženju za dosego
Reševanje problemov in algoritmi
 Reševanje problemov in algoritmi Vhod Algoritem Izhod Kaj bomo spoznali Zgodovina algoritmov. Primeri algoritmov. Algoritmi in programi. Kaj je algoritem? Algoritem je postopek, kako korak za korakom rešimo
Reševanje problemov in algoritmi Vhod Algoritem Izhod Kaj bomo spoznali Zgodovina algoritmov. Primeri algoritmov. Algoritmi in programi. Kaj je algoritem? Algoritem je postopek, kako korak za korakom rešimo
Determining the Leakage Flow through Water Turbines and Inlet- Water Gate in the Doblar 2 Hydro Power Plant
 Elektrotehniški vestnik 77(4): 39-44, 010 Electrotechnical Review: Ljubljana, Slovenija Določanje puščanja vodnih turbin in predturbinskih zapornic v hidroelektrarni Doblar Miha Leban 1, Rajko Volk 1,
Elektrotehniški vestnik 77(4): 39-44, 010 Electrotechnical Review: Ljubljana, Slovenija Določanje puščanja vodnih turbin in predturbinskih zapornic v hidroelektrarni Doblar Miha Leban 1, Rajko Volk 1,
Stopnja protolize(disociacije) - merilo za jakost elektrolita. = c d /c
 Stopnja protolize(disociacije) - merilo za jakost elektrolita = N/N 0 = n/n 0 = c d /c = stopnja protolize (disociacije) N = število disociiranih molekul (HCl) oz. formulskih enot (NaCl) N 0 = število
Stopnja protolize(disociacije) - merilo za jakost elektrolita = N/N 0 = n/n 0 = c d /c = stopnja protolize (disociacije) N = število disociiranih molekul (HCl) oz. formulskih enot (NaCl) N 0 = število
VAJA 1: Vzorčenje in priprava vzorcev za analizo
 1 VAJA 1: Vzorčenje in priprava vzorcev za analizo Vzorčenje zemlje Vzorec, ki je namenjen laboratorijski analizi predstavlja ponavadi le majhen del mnogo večjega prvotnega vzorca ali materiala o katerem
1 VAJA 1: Vzorčenje in priprava vzorcev za analizo Vzorčenje zemlje Vzorec, ki je namenjen laboratorijski analizi predstavlja ponavadi le majhen del mnogo večjega prvotnega vzorca ali materiala o katerem
1. V čašo damo nekaj kock ledu in mrzle vode. Katera ugotovitev ni pravilna?
 1. V čašo damo nekaj kock ledu in mrzle vode. Katera ugotovitev ni pravilna? A. V čaši je čista snov. B. V čaši sta dve različni snovi. C. Led je čista snov. D. Led in tekoča voda sta ista čista snov.
1. V čašo damo nekaj kock ledu in mrzle vode. Katera ugotovitev ni pravilna? A. V čaši je čista snov. B. V čaši sta dve različni snovi. C. Led je čista snov. D. Led in tekoča voda sta ista čista snov.
1) V diagramu sta prikazana plazemska koncentracijska profila po večkratnem intravenskem odmerjanju učinkovine v dveh različnih primerih (1 in 2).
 NALOGE ) V diagramu sta prikazana plazemska koncentracijska profila po večkratnem intravenskem odmerjanju učinkovine v dveh različnih primerih ( in ). 0.8 0.6 0.4 0. 0.0 0.08 0.06 0.04 0.0 0.00 0 0 0 30
NALOGE ) V diagramu sta prikazana plazemska koncentracijska profila po večkratnem intravenskem odmerjanju učinkovine v dveh različnih primerih ( in ). 0.8 0.6 0.4 0. 0.0 0.08 0.06 0.04 0.0 0.00 0 0 0 30
Acta Chim. Slov. 2003, 50,
 771 IMPACT OF STRUCTURED PACKING ON BUBBE COUMN MASS TRANSFER CHARACTERISTICS EVAUATION. Part 3. Sensitivity of ADM Volumetric Mass Transfer Coefficient evaluation Ana akota Faculty of Chemistry and Chemical
771 IMPACT OF STRUCTURED PACKING ON BUBBE COUMN MASS TRANSFER CHARACTERISTICS EVAUATION. Part 3. Sensitivity of ADM Volumetric Mass Transfer Coefficient evaluation Ana akota Faculty of Chemistry and Chemical
UNIVERZA NA PRIMORSKEM FAKULTETA ZA MATEMATIKO, NARAVOSLOVJE IN INFORMACIJSKE TEHNOLOGIJE. O neeksaknotsti eksaktnega binomskega intervala zaupanja
 UNIVERZA NA PRIMORSKEM FAKULTETA ZA MATEMATIKO, NARAVOSLOVJE IN INFORMACIJSKE TEHNOLOGIJE Zaključna naloga (Final project paper) O neeksaknotsti eksaktnega binomskega intervala zaupanja (On the inexactness
UNIVERZA NA PRIMORSKEM FAKULTETA ZA MATEMATIKO, NARAVOSLOVJE IN INFORMACIJSKE TEHNOLOGIJE Zaključna naloga (Final project paper) O neeksaknotsti eksaktnega binomskega intervala zaupanja (On the inexactness
Calculation of stress-strain dependence from tensile tests at high temperatures using final shapes of specimen s contours
 RMZ Materials and Geoenvironment, Vol. 59, No. 4, pp. 331 346, 2012 331 Calculation of stress-strain dependence from tensile tests at high temperatures using final shapes of specimen s contours Določitev
RMZ Materials and Geoenvironment, Vol. 59, No. 4, pp. 331 346, 2012 331 Calculation of stress-strain dependence from tensile tests at high temperatures using final shapes of specimen s contours Določitev
Materiali za shranjevanje vodika
 Univerza v Ljubljani Fakulteta za matematiko in fiziko Oddelek za fiziko Seminar Materiali za shranjevanje vodika Avtor: Jaka Petelin Mentor: dr. Denis Arčon Ljubljana, Maj 008 Povzetek V seminarju bom
Univerza v Ljubljani Fakulteta za matematiko in fiziko Oddelek za fiziko Seminar Materiali za shranjevanje vodika Avtor: Jaka Petelin Mentor: dr. Denis Arčon Ljubljana, Maj 008 Povzetek V seminarju bom
Dušan Čalić. Meritev pozitivnega temperaturnega koeficienta reaktivnosti v reaktorju TRIGA SEMINAR
 UNIVERZA V LJUBLJANI FAKULTETA ZA MATEMATIKO IN FIZIKO Oddelek za fiziko Dušan Čalić Meritev pozitivnega temperaturnega koeficienta reaktivnosti v reaktorju TRIGA SEMINAR Mentor: prof. dr. Matjaž Ravnik
UNIVERZA V LJUBLJANI FAKULTETA ZA MATEMATIKO IN FIZIKO Oddelek za fiziko Dušan Čalić Meritev pozitivnega temperaturnega koeficienta reaktivnosti v reaktorju TRIGA SEMINAR Mentor: prof. dr. Matjaž Ravnik
Nelinearna regresija. SetOptions Plot, ImageSize 6 72, Frame True, GridLinesStyle Directive Gray, Dashed, Method "GridLinesInFront" True,
 Nelinearna regresija In[1]:= SetOptions ListPlot, ImageSize 6 72, Frame True, GridLinesStyle Directive Gray, Dashed, Method "GridLinesInFront" True, PlotStyle Directive Thickness Medium, PointSize Large,
Nelinearna regresija In[1]:= SetOptions ListPlot, ImageSize 6 72, Frame True, GridLinesStyle Directive Gray, Dashed, Method "GridLinesInFront" True, PlotStyle Directive Thickness Medium, PointSize Large,
PREDICTION OF SUPERCONDUCTING TRANSITION TEMPERATURE USING A MACHINE-LEARNING METHOD
 UDK 620:538.945.91 ISSN 1580-2949 Original scientific article/izvirni znanstveni ~lanek MTAEC9, 52(5)639(2018) Y. LIU et al.: PREDICTION OF SUPERCONDUCTING TRANSITION TEMPERATURE USING A MACHINE-LEARNING
UDK 620:538.945.91 ISSN 1580-2949 Original scientific article/izvirni znanstveni ~lanek MTAEC9, 52(5)639(2018) Y. LIU et al.: PREDICTION OF SUPERCONDUCTING TRANSITION TEMPERATURE USING A MACHINE-LEARNING
The Partial Specific Volume of P-Lactoglobulin A in Aqueous Urea Solutions
 CR 0 AT IC A CHEMIC A ACT A 43 (1971) CCA641 65 541.11 :547.96 Original Scientific Paper The Partial Specific Volume of PLactoglobulin A in Aqueous Urea Solutions S. Lapanje, J. Skerjanc, and V. Dolecek
CR 0 AT IC A CHEMIC A ACT A 43 (1971) CCA641 65 541.11 :547.96 Original Scientific Paper The Partial Specific Volume of PLactoglobulin A in Aqueous Urea Solutions S. Lapanje, J. Skerjanc, and V. Dolecek
TERMODINAMIKA, BIOENERGETIKA
 TERMODINAMIKA, BIOENERGETIKA Osnovni termodinamski koncepti Fizikalni pomen termodinamskih količin ph in standardni pogoji Sklopljeni procesi Energijsko bogate biomolekule Osnovni termodinamski koncepti
TERMODINAMIKA, BIOENERGETIKA Osnovni termodinamski koncepti Fizikalni pomen termodinamskih količin ph in standardni pogoji Sklopljeni procesi Energijsko bogate biomolekule Osnovni termodinamski koncepti
UČNI NAČRT PREDMETA / COURSE SYLLABUS (leto / year 2017/18) Parcialne diferencialne enačbe Partial differential equations. Študijska smer Study field
 Predmet: Course title: UČNI NAČRT PREDMETA / COURSE SYLLABUS (leto / year 2017/18) Parcialne diferencialne enačbe Partial differential equations Študijski program in stopnja Study programme and level Magistrski
Predmet: Course title: UČNI NAČRT PREDMETA / COURSE SYLLABUS (leto / year 2017/18) Parcialne diferencialne enačbe Partial differential equations Študijski program in stopnja Study programme and level Magistrski
POLUTANTI V ATMOSFERI
 Matej Kapus SEMINAR POLUTANTI V ATMOSFERI Mentor: Prof. Andrej Likar Zahvala: Prof. Tomaž Vrhovec Mag. Andrej Kobe (ARSO) November, 00 Povzetek V zapisu predstavljam osnove iz področja ekologije zraka.
Matej Kapus SEMINAR POLUTANTI V ATMOSFERI Mentor: Prof. Andrej Likar Zahvala: Prof. Tomaž Vrhovec Mag. Andrej Kobe (ARSO) November, 00 Povzetek V zapisu predstavljam osnove iz področja ekologije zraka.
TEMPERATURNO INDUCIRAN FAZNI PREHOD NEMATIČNEGA TEKOČEGA KRISTALA. Uroš Jagodič
 TEMPERATURNO INDUCIRAN FAZNI PREHOD NEMATIČNEGA TEKOČEGA KRISTALA Diplomski seminar na bolonjskem študijskem programu 1. stopnje Fizika Uroš Jagodič Mentor: red. prof. dr. Samo Kralj Somentor: mag. Robert
TEMPERATURNO INDUCIRAN FAZNI PREHOD NEMATIČNEGA TEKOČEGA KRISTALA Diplomski seminar na bolonjskem študijskem programu 1. stopnje Fizika Uroš Jagodič Mentor: red. prof. dr. Samo Kralj Somentor: mag. Robert
Odgovor rastlin na povečane koncentracije CO 2. Ekofiziologija in mineralna prehrana rastlin
 Odgovor rastlin na povečane koncentracije CO 2 Ekofiziologija in mineralna prehrana rastlin Spremembe koncentracije CO 2 v atmosferi merilna postaja Mauna Loa, Hawaii. koncentracija CO 2 [μmol mol -1 ]
Odgovor rastlin na povečane koncentracije CO 2 Ekofiziologija in mineralna prehrana rastlin Spremembe koncentracije CO 2 v atmosferi merilna postaja Mauna Loa, Hawaii. koncentracija CO 2 [μmol mol -1 ]
FIZIKA VIRUSOV. Avtor: Miran Dragar Mentor: prof. dr. Rudolf Podgornik. Maj Povzetek
 UNIVERZA V LJUBLJANI Fakulteta za matematiko in fiziko Oddelek za fiziko FIZIKA VIRUSOV Avtor: Miran Dragar Mentor: prof. dr. Rudolf Podgornik Maj 2007 Povzetek V seminarju bo predstavljen preprost model,
UNIVERZA V LJUBLJANI Fakulteta za matematiko in fiziko Oddelek za fiziko FIZIKA VIRUSOV Avtor: Miran Dragar Mentor: prof. dr. Rudolf Podgornik Maj 2007 Povzetek V seminarju bo predstavljen preprost model,
Raziskave afinitete zeolitov za pare različnih topil
 Gregor Mlakar Raziskave afinitete zeolitov za pare različnih topil Magistrsko delo Maribor, april 2015 Magistrsko delo študijskega programa II. stopnje Študent: Študijski program: Predvideni strokovni
Gregor Mlakar Raziskave afinitete zeolitov za pare različnih topil Magistrsko delo Maribor, april 2015 Magistrsko delo študijskega programa II. stopnje Študent: Študijski program: Predvideni strokovni
REGULACIJA ULTRASENZITIVNOSTI LINEARNO SKLOPLJENIH PROTEINSKIH KASKAD
 REGULACIJA ULTRASENZITIVNOSTI LINEARNO SKLOPLJENIH PROTEINSKIH KASKAD Seminar iz fizike na dvopredmetnem študijskem programu Fizika (stari program) Aleš Vunjak Mentor: asist. dr. Rene Markovič Maribor,
REGULACIJA ULTRASENZITIVNOSTI LINEARNO SKLOPLJENIH PROTEINSKIH KASKAD Seminar iz fizike na dvopredmetnem študijskem programu Fizika (stari program) Aleš Vunjak Mentor: asist. dr. Rene Markovič Maribor,
Značilnice gonilnika radialne plinske turbine Rotor Characteristics of Radial Gas Turbine
 UDK 621.438 Značilnice gonilnika radialne plinske turbine Rotor Characteristics of Radial Gas Turbine ALEŠ HRIBERNIK - ŽELIMIR DOBOVIŠEK V prispevku so predstavljene značilnice gonilnika turbine. Definirane
UDK 621.438 Značilnice gonilnika radialne plinske turbine Rotor Characteristics of Radial Gas Turbine ALEŠ HRIBERNIK - ŽELIMIR DOBOVIŠEK V prispevku so predstavljene značilnice gonilnika turbine. Definirane
ija 3 m Kislost-bazi - čnost Hammettove konstante ska ke acevt Farm Izr. prof. dr Izr. prof. dr. Marko Anderluh. Marko Anderluh 23 oktober.
 acevts ska kem mija 3 Farm Kislost-bazičnost Hammettove konstante Izr. prof. dr. Marko Anderluh 23. oktober 2012 Vpliv kislinsko bazičnih lastnosti Vezava na tarčno mesto farmakodinamsko delovanje Topnost/sproščanje
acevts ska kem mija 3 Farm Kislost-bazičnost Hammettove konstante Izr. prof. dr. Marko Anderluh 23. oktober 2012 Vpliv kislinsko bazičnih lastnosti Vezava na tarčno mesto farmakodinamsko delovanje Topnost/sproščanje
MECHANICAL EFFICIENCY, WORK AND HEAT OUTPUT IN RUNNING UPHILL OR DOWNHILL
 original scientific article UDC: 796.4 received: 2011-05-03 MECHANICAL EFFICIENCY, WORK AND HEAT OUTPUT IN RUNNING UPHILL OR DOWNHILL Pietro Enrico DI PRAMPERO University of Udine, Department of Biomedical
original scientific article UDC: 796.4 received: 2011-05-03 MECHANICAL EFFICIENCY, WORK AND HEAT OUTPUT IN RUNNING UPHILL OR DOWNHILL Pietro Enrico DI PRAMPERO University of Udine, Department of Biomedical
Transport snovi preko celičnih membran. Lodish et al. 4. izdaja, 15. poglavje (str )
 Transport snovi preko celičnih membran Lodish et al. 4. izdaja, 15. poglavje (str. 578 615) Relativna propustnost fosfolipidnega dvosloja za različne molekule Načini transporta snovi preko celičnih membran
Transport snovi preko celičnih membran Lodish et al. 4. izdaja, 15. poglavje (str. 578 615) Relativna propustnost fosfolipidnega dvosloja za različne molekule Načini transporta snovi preko celičnih membran
(Received )
 79 Acta Chim. Slov. 1997, 45(1), pp. 79-84 (Received 28.1.1999) THE INFLUENCE OF THE PROTEINASE INHIBITOR EP475 ON SOME MORPHOLOGICAL CHARACTERISTICS OF POTATO PLANTS (Solanum tuberosum L. cv. Desirée)
79 Acta Chim. Slov. 1997, 45(1), pp. 79-84 (Received 28.1.1999) THE INFLUENCE OF THE PROTEINASE INHIBITOR EP475 ON SOME MORPHOLOGICAL CHARACTERISTICS OF POTATO PLANTS (Solanum tuberosum L. cv. Desirée)
1 Luna kot uniformni disk
 1 Luna kot uniformni disk Temperatura lune se spreminja po površini diska v širokem razponu, ampak lahko luno prikažemo kot uniformni disk z povprečno temperaturo osvetlitve (brightness temperature) izraženo
1 Luna kot uniformni disk Temperatura lune se spreminja po površini diska v širokem razponu, ampak lahko luno prikažemo kot uniformni disk z povprečno temperaturo osvetlitve (brightness temperature) izraženo
Delovanje gorivnih celic in njihova uporaba v industriji električnih vozil. avtor: Gorazd Lampič. mentor: Prof. dr. Jadran Maček.
 Delovanje gorivnih celic in njihova uporaba v industriji električnih vozil (seminar) avtor: Gorazd Lampič Povzetek mentor: Prof. dr. Jadran Maček November 003 Izkoristek je pri gorivnih celicah bistveno
Delovanje gorivnih celic in njihova uporaba v industriji električnih vozil (seminar) avtor: Gorazd Lampič Povzetek mentor: Prof. dr. Jadran Maček November 003 Izkoristek je pri gorivnih celicah bistveno
Baroklina nestabilnost
 Baroklina nestabilnost Navodila za projektno nalogo iz dinamične meteorologije 2012/2013 Januar 2013 Nedjeljka Zagar in Rahela Zabkar Naloga je zasnovana na dvoslojnem modelu baroklinega razvoja, napisana
Baroklina nestabilnost Navodila za projektno nalogo iz dinamične meteorologije 2012/2013 Januar 2013 Nedjeljka Zagar in Rahela Zabkar Naloga je zasnovana na dvoslojnem modelu baroklinega razvoja, napisana
BIOETANOL. (poročilo o izdelavi bioetanola) Avtorice: Katja Hočevar, Anita Hočevar, Tjaša Lampe, Medea Lebar, 3.N Mentorja: Anita Zupanc, Jure Ausec
 BIOETANOL (poročilo o izdelavi bioetanola) Avtorice: Katja Hočevar, Anita Hočevar, Tjaša Lampe, Medea Lebar, 3.N Mentorja: Anita Zupanc, Jure Ausec Izvedeno v okviru projekta Zeleni watt, ki ga je sofinanciral
BIOETANOL (poročilo o izdelavi bioetanola) Avtorice: Katja Hočevar, Anita Hočevar, Tjaša Lampe, Medea Lebar, 3.N Mentorja: Anita Zupanc, Jure Ausec Izvedeno v okviru projekta Zeleni watt, ki ga je sofinanciral
HIGGSOV MEHANIZEM MITJA FRIDMAN. Fakulteta za matematiko in fiziko Univerza v Ljubljani
 HIGGSOV MEHANIZEM MITJA FRIDMAN Fakulteta za matematiko in fiziko Univerza v Ljubljani V članku je predstavljen Higgsov mehanizem, ki opisuje generiranje mase osnovnih delcev. Vpeljan je Lagrangeov formalizem,
HIGGSOV MEHANIZEM MITJA FRIDMAN Fakulteta za matematiko in fiziko Univerza v Ljubljani V članku je predstavljen Higgsov mehanizem, ki opisuje generiranje mase osnovnih delcev. Vpeljan je Lagrangeov formalizem,
Varnost kemijskih procesov
 Univerza v Mariboru Fakulteta za kemijo in kemijsko tehnologijo Varnost kemijskih procesov (Zbrano gradivo) Zorka Novak Pintarič Maribor, 2008/2009 Naslov: Varnost kemijskih procesov Avtor: Zorka Novak
Univerza v Mariboru Fakulteta za kemijo in kemijsko tehnologijo Varnost kemijskih procesov (Zbrano gradivo) Zorka Novak Pintarič Maribor, 2008/2009 Naslov: Varnost kemijskih procesov Avtor: Zorka Novak
Univerza v Ljubljani, Fakulteta za matematiko in fiziko. Seminar
 Univerza v Ljubljani, Fakulteta za matematiko in fiziko Seminar Disperzijski modeli za modeliranje izpustov Avtor: Maruška Mole Mentor: asist. Rahela Žabkar Ljubljana, februar 2009 Povzetek Seminar predstavi
Univerza v Ljubljani, Fakulteta za matematiko in fiziko Seminar Disperzijski modeli za modeliranje izpustov Avtor: Maruška Mole Mentor: asist. Rahela Žabkar Ljubljana, februar 2009 Povzetek Seminar predstavi
Sinteza homologov paracetamola
 Katedra za farmacevtsko kemijo Sinteza homologov paracetamola Vaje iz Farmacevtske kemije 3 1 Sinteza N-(4-hidroksifenil)dekanamida Vaje iz Farmacevtske kemije 3 2 Praktična izvedba sinteze 1. 4-aminofenol
Katedra za farmacevtsko kemijo Sinteza homologov paracetamola Vaje iz Farmacevtske kemije 3 1 Sinteza N-(4-hidroksifenil)dekanamida Vaje iz Farmacevtske kemije 3 2 Praktična izvedba sinteze 1. 4-aminofenol
UNIVERZA V LJUBLJANI PEDAGOŠKA FAKULTETA POLONA ŠENKINC REŠEVANJE LINEARNIH DIFERENCIALNIH ENAČB DRUGEGA REDA S POMOČJO POTENČNIH VRST DIPLOMSKO DELO
 UNIVERZA V LJUBLJANI PEDAGOŠKA FAKULTETA POLONA ŠENKINC REŠEVANJE LINEARNIH DIFERENCIALNIH ENAČB DRUGEGA REDA S POMOČJO POTENČNIH VRST DIPLOMSKO DELO LJUBLJANA, 2016 UNIVERZA V LJUBLJANI PEDAGOŠKA FAKULTETA
UNIVERZA V LJUBLJANI PEDAGOŠKA FAKULTETA POLONA ŠENKINC REŠEVANJE LINEARNIH DIFERENCIALNIH ENAČB DRUGEGA REDA S POMOČJO POTENČNIH VRST DIPLOMSKO DELO LJUBLJANA, 2016 UNIVERZA V LJUBLJANI PEDAGOŠKA FAKULTETA
Meritve Casimirjevega efekta z nanomembranami
 Oddelek za fiziko Seminar a -. letnik, II. stopnja Meritve Casimirjevega efekta z nanomembranami avtor: Žiga Kos mentor: prof. dr. Rudolf Podgornik Ljubljana, 29. januar 203 Povzetek V tem seminarju bo
Oddelek za fiziko Seminar a -. letnik, II. stopnja Meritve Casimirjevega efekta z nanomembranami avtor: Žiga Kos mentor: prof. dr. Rudolf Podgornik Ljubljana, 29. januar 203 Povzetek V tem seminarju bo
Apparently Opposing Effects of Temperature and Guanidinium Chloride in the Denaturation of Ribonuclease A
 CROATICA CHEMICA ACTA CCACAA 51 (4) 36168 (1978) CCA-1133 YU ISSN 0011-1643 577.15 OriginaL Scientific Paper Apparently Opposing Effects of Temperature and Guanidinium Chloride in the Denaturation of Ribonuclease
CROATICA CHEMICA ACTA CCACAA 51 (4) 36168 (1978) CCA-1133 YU ISSN 0011-1643 577.15 OriginaL Scientific Paper Apparently Opposing Effects of Temperature and Guanidinium Chloride in the Denaturation of Ribonuclease
Multipla korelacija in regresija. Multipla regresija, multipla korelacija, statistično zaključevanje o multiplem R
 Multipla koelacia in egesia Multipla egesia, multipla koelacia, statistično zaklučevane o multiplem Multipla egesia osnovni model in ačunane paametov Z multiplo egesio napoveduemo vednost kiteia (odvisne
Multipla koelacia in egesia Multipla egesia, multipla koelacia, statistično zaklučevane o multiplem Multipla egesia osnovni model in ačunane paametov Z multiplo egesio napoveduemo vednost kiteia (odvisne
CONDENSATION CORROSION: A THEORETICAL APPROACH
 ACTA CARSOLOGICA 34/2 2 317-348 LJUBLJANA 2005 COBISS: 1.01 CONDENSATION CORROSION: A THEORETICAL APPROACH KONDENZACIJSKA KOROZIJA: TEORETIČNI PRISTOP WOLFGANG DREYBRODT 1,2, FRANCI GABROVŠEK 2 & MATIJA
ACTA CARSOLOGICA 34/2 2 317-348 LJUBLJANA 2005 COBISS: 1.01 CONDENSATION CORROSION: A THEORETICAL APPROACH KONDENZACIJSKA KOROZIJA: TEORETIČNI PRISTOP WOLFGANG DREYBRODT 1,2, FRANCI GABROVŠEK 2 & MATIJA
EINSTEINOVI NIHAJNI NAČINI ATOMOV V KLETKAH KLATRATA
 EINSTEINOVI NIHAJNI NAČINI ATOMOV V KLETKAH KLATRATA Diplomski seminar na bolonjskem študijskem programu 1. stopnje Fizika Vanja Sandrin Mentor: doc. dr. Marko Jagodič Maribor, 2013 SANDRIN, V.: Einsteinovi
EINSTEINOVI NIHAJNI NAČINI ATOMOV V KLETKAH KLATRATA Diplomski seminar na bolonjskem študijskem programu 1. stopnje Fizika Vanja Sandrin Mentor: doc. dr. Marko Jagodič Maribor, 2013 SANDRIN, V.: Einsteinovi
Iskanje najcenejše poti v grafih preko polkolobarjev
 Univerza v Ljubljani Fakulteta za računalništvo in informatiko Veronika Horvat Iskanje najcenejše poti v grafih preko polkolobarjev DIPLOMSKO DELO VISOKOŠOLSKI STROKOVNI ŠTUDIJSKI PROGRAM PRVE STOPNJE
Univerza v Ljubljani Fakulteta za računalništvo in informatiko Veronika Horvat Iskanje najcenejše poti v grafih preko polkolobarjev DIPLOMSKO DELO VISOKOŠOLSKI STROKOVNI ŠTUDIJSKI PROGRAM PRVE STOPNJE
USING THE DIRECTION OF THE SHOULDER S ROTATION ANGLE AS AN ABSCISSA AXIS IN COMPARATIVE SHOT PUT ANALYSIS. Matej Supej* Milan Čoh
 Kinesiologia Slovenica, 14, 3, 5 14 (28) Faculty of Sport, University of Ljubljana, ISSN 1318-2269 5 Matej Supej* Milan Čoh USING THE DIRECTION OF THE SHOULDER S ROTATION ANGLE AS AN ABSCISSA AXIS IN COMPARATIVE
Kinesiologia Slovenica, 14, 3, 5 14 (28) Faculty of Sport, University of Ljubljana, ISSN 1318-2269 5 Matej Supej* Milan Čoh USING THE DIRECTION OF THE SHOULDER S ROTATION ANGLE AS AN ABSCISSA AXIS IN COMPARATIVE
Numerical simulation aided design of the selective electromagnetic trigger
 Elektrotehniški vestnik 74(5): 73-78, 7 Electrotechnical Review: Ljubljana, Slovenija Načrtovanje elektromagnetnega sprožnika s pomočjo numerične simulacije Borut Drnovšek, Dejan Križaj ETI Elektroelement
Elektrotehniški vestnik 74(5): 73-78, 7 Electrotechnical Review: Ljubljana, Slovenija Načrtovanje elektromagnetnega sprožnika s pomočjo numerične simulacije Borut Drnovšek, Dejan Križaj ETI Elektroelement
Seminar - 1. letnik bolonjske magistrske stopnje. O energijskih bilanci v fuzijskem reaktorju - Lawsonov kriterij. Avtor: Matic Kunšek
 Seminar - 1. letnik bolonjske magistrske stopnje O energijskih bilanci v fuzijskem reaktorju - Lawsonov kriterij Avtor: Matic Kunšek Mentor: dr. Tomaž Gyergyek Ljubljana, marec 2014 Povzetek: V tem seminarju
Seminar - 1. letnik bolonjske magistrske stopnje O energijskih bilanci v fuzijskem reaktorju - Lawsonov kriterij Avtor: Matic Kunšek Mentor: dr. Tomaž Gyergyek Ljubljana, marec 2014 Povzetek: V tem seminarju
Cveto Trampuž PRIMERJAVA ANALIZE VEČRAZSEŽNIH TABEL Z RAZLIČNIMI MODELI REGRESIJSKE ANALIZE DIHOTOMNIH SPREMENLJIVK
 Cveto Trampuž PRIMERJAVA ANALIZE VEČRAZSEŽNIH TABEL Z RAZLIČNIMI MODELI REGRESIJSKE ANALIZE DIHOTOMNIH SPREMENLJIVK POVZETEK. Namen tega dela je prikazati osnove razlik, ki lahko nastanejo pri interpretaciji
Cveto Trampuž PRIMERJAVA ANALIZE VEČRAZSEŽNIH TABEL Z RAZLIČNIMI MODELI REGRESIJSKE ANALIZE DIHOTOMNIH SPREMENLJIVK POVZETEK. Namen tega dela je prikazati osnove razlik, ki lahko nastanejo pri interpretaciji
Študijska smer Study field. Samost. delo Individ. work Klinične vaje work. Vaje / Tutorial: Slovensko/Slovene
 UČNI NAČRT PREDMETA / COURSE SYLLABUS Predmet: Kvantna mehanika Course title: Quantum mechanics Študijski program in stopnja Study programme and level Univerzitetni študijski program 1.stopnje Fizika First
UČNI NAČRT PREDMETA / COURSE SYLLABUS Predmet: Kvantna mehanika Course title: Quantum mechanics Študijski program in stopnja Study programme and level Univerzitetni študijski program 1.stopnje Fizika First
Modeling and Control of Instabilities in Combustion Processes Modeliranje in upravljanje nestabilnosti v procesih zgorevanja
 Izvirni znanstveni članek TEHNIKA - nestabilni termoakustični procesi zgorevanja Datum prejema: 30. julij 2014 ANALI PAZU 4/ 2014/ 1: 34-40 www.anali-pazu.si Modeling and Control of Instabilities in Combustion
Izvirni znanstveni članek TEHNIKA - nestabilni termoakustični procesi zgorevanja Datum prejema: 30. julij 2014 ANALI PAZU 4/ 2014/ 1: 34-40 www.anali-pazu.si Modeling and Control of Instabilities in Combustion
Vpliv navitja na prostorske harmonske komponente enofaznega motorja z obratovalnim kondenzatorjem
 Elektrotehniški vestnik 69(3-4): 175 180, 00 Electrotechnical Review, Ljubljana, Slovenija Vpliv navitja na prostorske harmonske komponente enofaznega motorja z obratovalnim kondenzatorjem Ivan Zagradišnik,
Elektrotehniški vestnik 69(3-4): 175 180, 00 Electrotechnical Review, Ljubljana, Slovenija Vpliv navitja na prostorske harmonske komponente enofaznega motorja z obratovalnim kondenzatorjem Ivan Zagradišnik,
Sinteza homologov paracetamola
 Katedra za farmacevtsko kemijo Sinteza homologov paracetamola Vaje iz Farmacevtske kemije 3 1 Sinteza N-(4-hidroksifenil)dekanamida Vaje iz Farmacevtske kemije 3 2 Vprašanja: 1. Zakaj uporabimo zmes voda/dioksan?
Katedra za farmacevtsko kemijo Sinteza homologov paracetamola Vaje iz Farmacevtske kemije 3 1 Sinteza N-(4-hidroksifenil)dekanamida Vaje iz Farmacevtske kemije 3 2 Vprašanja: 1. Zakaj uporabimo zmes voda/dioksan?
Solid Phase Extraction of Arsenic by Sorption on Naphthalene-Methyltrioctyl Ammonium Chloride and Spectrophotometric Determination
 Scientific Paper by Sorption on Naphthalene-Methyltrioctyl Ammonium Chloride and Spectrophotometric Determination Mohsen Behpour,* Sayed Mehdi Ghoreishi, and Sakineh Salehi 323 Department of Chemistry,
Scientific Paper by Sorption on Naphthalene-Methyltrioctyl Ammonium Chloride and Spectrophotometric Determination Mohsen Behpour,* Sayed Mehdi Ghoreishi, and Sakineh Salehi 323 Department of Chemistry,
GEOMETRIJSKE FAZE V KVANTNI MEHANIKI
 GEOMETRIJSKE FAZE V KVANTNI MEHANIKI LARA ULČAKAR Fakulteta za matematiko in fiziko Univerza v Ljubljani V članku so predstavljene geometrijske faze, ki nastopijo pri obravnavi kvantnih sistemov. Na začetku
GEOMETRIJSKE FAZE V KVANTNI MEHANIKI LARA ULČAKAR Fakulteta za matematiko in fiziko Univerza v Ljubljani V članku so predstavljene geometrijske faze, ki nastopijo pri obravnavi kvantnih sistemov. Na začetku
Destilacija naravoslovja?
 Fizikalno ali kemijsko? Destilacija naravoslovja? Jaka Banko in Andreja Bačnik Zavod RS za šolstvo Laško, avgust 2015 Projekt Scientix (2012-2015) črpa sredstva iz okvirnega programa Evropske unije za
Fizikalno ali kemijsko? Destilacija naravoslovja? Jaka Banko in Andreja Bačnik Zavod RS za šolstvo Laško, avgust 2015 Projekt Scientix (2012-2015) črpa sredstva iz okvirnega programa Evropske unije za
Magnetizem bakrovih dimerov
 Magnetizem bakrovih dimerov Diplomski seminar na bolonjskem študijskem programu 1. stopnje Fizika Urška Moraus Mentor: doc. dr. Marko Jagodič Maribor, 2013 Moraus, U: Magnetizem bakrovih dimerov Diplomski
Magnetizem bakrovih dimerov Diplomski seminar na bolonjskem študijskem programu 1. stopnje Fizika Urška Moraus Mentor: doc. dr. Marko Jagodič Maribor, 2013 Moraus, U: Magnetizem bakrovih dimerov Diplomski
JEDRSKA URA JAN JURKOVIČ. Fakulteta za matematiko in fiziko Univerza v Ljubljani
 JEDRSKA URA JAN JURKOVIČ Fakulteta za matematiko in fiziko Univerza v Ljubljani Natančnost časa postaja vse bolj uporabna in pomembna, zato se rojevajo novi načini merjenja časa. Do danes najbolj natančnih
JEDRSKA URA JAN JURKOVIČ Fakulteta za matematiko in fiziko Univerza v Ljubljani Natančnost časa postaja vse bolj uporabna in pomembna, zato se rojevajo novi načini merjenja časa. Do danes najbolj natančnih
Tehnološko procesništvo
 2 blok : ponedeljek 10-12h in četrtek od 13-15h Tehnološko procesništvo doc. dr. Andreja Zupančič Valant prof. dr. Andrej Jamnik UL FKKT 1 Literatura: Fryer P. J., Pyle D. L., Rielly C. D. (Eds.), Chemical
2 blok : ponedeljek 10-12h in četrtek od 13-15h Tehnološko procesništvo doc. dr. Andreja Zupančič Valant prof. dr. Andrej Jamnik UL FKKT 1 Literatura: Fryer P. J., Pyle D. L., Rielly C. D. (Eds.), Chemical
ZDRAVLJENJE BOLNICE S VON WILLEBRANDOVO BOLEZNIJO TIPA 3 IN INHIBITORJI
 ZDRAVLJENJE BOLNICE S VON WILLEBRANDOVO BOLEZNIJO TIPA 3 IN INHIBITORJI B. Faganel Kotnik, L. Kitanovski, J. Jazbec, K. Strandberg, M. Debeljak, Bakija, M. Benedik Dolničar A. Trampuš Laško, 9. april 2016
ZDRAVLJENJE BOLNICE S VON WILLEBRANDOVO BOLEZNIJO TIPA 3 IN INHIBITORJI B. Faganel Kotnik, L. Kitanovski, J. Jazbec, K. Strandberg, M. Debeljak, Bakija, M. Benedik Dolničar A. Trampuš Laško, 9. april 2016
UNIVERZA NA PRIMORSKEM FAKULTETA ZA MATEMATIKO, NARAVOSLOVJE IN INFORMACIJSKE TEHNOLOGIJE
 UNIVERZA NA PRIMORSKEM FAKULTETA ZA MATEMATIKO, NARAVOSLOVJE IN INFORMACIJSKE TEHNOLOGIJE Zaključna naloga Uporaba logistične regresije za napovedovanje razreda, ko je število enot v preučevanih razredih
UNIVERZA NA PRIMORSKEM FAKULTETA ZA MATEMATIKO, NARAVOSLOVJE IN INFORMACIJSKE TEHNOLOGIJE Zaključna naloga Uporaba logistične regresije za napovedovanje razreda, ko je število enot v preučevanih razredih
P a g e 5 1 of R e p o r t P B 4 / 0 9
 P a g e 5 1 of R e p o r t P B 4 / 0 9 J A R T a l s o c o n c l u d e d t h a t a l t h o u g h t h e i n t e n t o f N e l s o n s r e h a b i l i t a t i o n p l a n i s t o e n h a n c e c o n n e
P a g e 5 1 of R e p o r t P B 4 / 0 9 J A R T a l s o c o n c l u d e d t h a t a l t h o u g h t h e i n t e n t o f N e l s o n s r e h a b i l i t a t i o n p l a n i s t o e n h a n c e c o n n e
UNIVERZA V LJUBLJANI FAKULTETA ZA FARMACIJO SARA ISLAMOVIĆ MAGISTRSKA NALOGA
 UNIVERZA V LJUBLJANI FAKULTETA ZA FARMACIJO SARA ISLAMOVIĆ VREDNOTENJE STRUKTURE LIOTROPNIH TEKOČIH KRISTALOV Z ELEKTRONSKO PARAMAGNETNO RESONANCO STRUCTURAL EVALUATION OF LYOTROPIC LIQUID CRYSTALS USING
UNIVERZA V LJUBLJANI FAKULTETA ZA FARMACIJO SARA ISLAMOVIĆ VREDNOTENJE STRUKTURE LIOTROPNIH TEKOČIH KRISTALOV Z ELEKTRONSKO PARAMAGNETNO RESONANCO STRUCTURAL EVALUATION OF LYOTROPIC LIQUID CRYSTALS USING
Analogna elektronska vezja. Uvodna vaja
 Analogna elektronska vezja Uvodna vaja Povzetek Namen uvodne vaje je, da študenti spoznajo orodja, ki jih bojo uporabljali pri laboratorijskih vajah predmeta Analogna elektronska vezja in sicer: podatkovne
Analogna elektronska vezja Uvodna vaja Povzetek Namen uvodne vaje je, da študenti spoznajo orodja, ki jih bojo uporabljali pri laboratorijskih vajah predmeta Analogna elektronska vezja in sicer: podatkovne
Univerza na Primorskem. Fakulteta za matematiko, naravoslovje in informacijske tehnologije. Zaznavanje gibov. Zaključna naloga
 Univerza na Primorskem Fakulteta za matematiko, naravoslovje in informacijske tehnologije Boštjan Markežič Zaznavanje gibov Zaključna naloga Koper, september 2011 Mentor: doc. dr. Peter Rogelj Kazalo Slovarček
Univerza na Primorskem Fakulteta za matematiko, naravoslovje in informacijske tehnologije Boštjan Markežič Zaznavanje gibov Zaključna naloga Koper, september 2011 Mentor: doc. dr. Peter Rogelj Kazalo Slovarček
Increasing process safety using analytical redundancy
 Elektrotehniški vestnik 69(3-4): 240 246, 2002 Electrotechnical Review, Ljubljana, Slovenija Increasing process safety using analytical redundancy Stojan Peršin, Boris Tovornik, Nenad Muškinja, Drago Valh
Elektrotehniški vestnik 69(3-4): 240 246, 2002 Electrotechnical Review, Ljubljana, Slovenija Increasing process safety using analytical redundancy Stojan Peršin, Boris Tovornik, Nenad Muškinja, Drago Valh
Zakasneli nevtroni v reaktorjih s tekočim gorivom
 Seminar Zakasneli nevtroni v reaktorjih s tekočim gorivom Avtor: Janez Kokalj januar, 2015 Mentor: Dr. Luka Snoj Povzetek Četrta generacija jedrskih reaktorjev, kamor spadajo tudi reaktorji na staljeno
Seminar Zakasneli nevtroni v reaktorjih s tekočim gorivom Avtor: Janez Kokalj januar, 2015 Mentor: Dr. Luka Snoj Povzetek Četrta generacija jedrskih reaktorjev, kamor spadajo tudi reaktorji na staljeno
UNIVERZA V LJUBLJANI FAKULTETA ZA FARMACIJO
 UNIVERZA V LJUBLJANI FAKULTETA ZA FARMACIJO NATAŠA HRIBERNIK VPLIV SAHAROZE IN PEKTINA V MEDIJIH RAZLIČNIH ph VREDNOSTI NA SPROŠČANJE PARACETAMOLA IZ TABLET S PRIREJENIM SPROŠČANJEM THE INFLUENCE OF SUCROSE
UNIVERZA V LJUBLJANI FAKULTETA ZA FARMACIJO NATAŠA HRIBERNIK VPLIV SAHAROZE IN PEKTINA V MEDIJIH RAZLIČNIH ph VREDNOSTI NA SPROŠČANJE PARACETAMOLA IZ TABLET S PRIREJENIM SPROŠČANJEM THE INFLUENCE OF SUCROSE
FOTONSKI POGON. Avtor: Črt Harej Mentor: prof. dr. Simon Širca. Ljubljana, Maj 2016
 FOTONSKI POGON Seminar I b - 1. letnik, II. stopnja Avtor: Črt Harej Mentor: prof. dr. Simon Širca Ljubljana, Maj 2016 Povzetek Človeštvo že skoraj 60 let raziskuje in uresničuje vesoljske polete. V tem
FOTONSKI POGON Seminar I b - 1. letnik, II. stopnja Avtor: Črt Harej Mentor: prof. dr. Simon Širca Ljubljana, Maj 2016 Povzetek Človeštvo že skoraj 60 let raziskuje in uresničuje vesoljske polete. V tem
Verifikacija napovedi padavin
 Oddelek za Meteorologijo Seminar: 4. letnik - univerzitetni program Verifikacija napovedi padavin Avtor: Matic Šavli Mentor: doc. dr. Nedjeljka Žagar 26. februar 2012 Povzetek Pojem verifikacije je v meteorologiji
Oddelek za Meteorologijo Seminar: 4. letnik - univerzitetni program Verifikacija napovedi padavin Avtor: Matic Šavli Mentor: doc. dr. Nedjeljka Žagar 26. februar 2012 Povzetek Pojem verifikacije je v meteorologiji
VAJE IZ BIOFARMACIJE S FARMAKOKINETIKO
 FAKULTETA ZA FARMACIJO KATEDRA ZA BIOFARMACIJO IN FARMAKOKINETIKO VAJE IZ BIOFARMACIJE S FARMAKOKINETIKO DNEVNIKI Ime in priimek: Turnus: Ljubljana, 2001 KAZALO 1. vaja: PORAZDELITVENI KOEFICIENT... 2
FAKULTETA ZA FARMACIJO KATEDRA ZA BIOFARMACIJO IN FARMAKOKINETIKO VAJE IZ BIOFARMACIJE S FARMAKOKINETIKO DNEVNIKI Ime in priimek: Turnus: Ljubljana, 2001 KAZALO 1. vaja: PORAZDELITVENI KOEFICIENT... 2
Pridobivanje klorovega dioksida za pripravo pitne vode The Generation of Chlorine Dioxide for drinking water treatment
 Strokovni članek Pridobivanje klorovega dioksida za pripravo pitne vode The Generation of Chlorine Dioxide for drinking water treatment F. KÜKE 1*, B. PEČENK POVZETEK Poenotenje nacionalnih predpisov za
Strokovni članek Pridobivanje klorovega dioksida za pripravo pitne vode The Generation of Chlorine Dioxide for drinking water treatment F. KÜKE 1*, B. PEČENK POVZETEK Poenotenje nacionalnih predpisov za
Geometrijske faze v kvantni mehaniki
 Seminar 1-1. letnik, 2. stopnja Geometrijske faze v kvantni mehaniki Avtor: Lara Ulčakar Mentor: prof. dr. Anton Ramšak Ljubljana, november 2014 Povzetek V seminarju so predstavljene geometrijske faze,
Seminar 1-1. letnik, 2. stopnja Geometrijske faze v kvantni mehaniki Avtor: Lara Ulčakar Mentor: prof. dr. Anton Ramšak Ljubljana, november 2014 Povzetek V seminarju so predstavljene geometrijske faze,
UNIVERZA NA PRIMORSKEM FAKULTETA ZA MATEMATIKO, NARAVOSLOVJE IN INFORMACIJSKE TEHNOLOGIJE
 UNIVERZA NA PRIMORSKEM FAKULTETA ZA MATEMATIKO, NARAVOSLOVJE IN INFORMACIJSKE TEHNOLOGIJE Zaključna naloga Primerjava modernih pristopov za identifikacijo pomembno izraženih genov za dve skupini (Comparison
UNIVERZA NA PRIMORSKEM FAKULTETA ZA MATEMATIKO, NARAVOSLOVJE IN INFORMACIJSKE TEHNOLOGIJE Zaključna naloga Primerjava modernih pristopov za identifikacijo pomembno izraženih genov za dve skupini (Comparison
USING SIMULATED SPECTRA TO TEST THE EFFICIENCY OF SPECTRAL PROCESSING SOFTWARE IN REDUCING THE NOISE IN AUGER ELECTRON SPECTRA
 UDK 543.428.2:544.171.7 ISSN 1580-2949 Original scientific article/izvirni znanstveni ~lanek MTAEC9, 49(3)435(2015) B. PONIKU et al.: USING SIMULATED SPECTRA TO TEST THE EFFICIENCY... USING SIMULATED SPECTRA
UDK 543.428.2:544.171.7 ISSN 1580-2949 Original scientific article/izvirni znanstveni ~lanek MTAEC9, 49(3)435(2015) B. PONIKU et al.: USING SIMULATED SPECTRA TO TEST THE EFFICIENCY... USING SIMULATED SPECTRA
Acta Chim. Slov. 2000, 47, Macroion-macroion correlations in the presence of divalent counterions. Effects of a simple electrolyte B. Hrib
 Acta Chim. Slov. 2000, 47, 123-131 123 Macroion-macroion correlations in the presence of divalent counterions. Effects of a simple electrolyte B. Hribar and V. Vlachy Faculty of Chemistry and Chemical
Acta Chim. Slov. 2000, 47, 123-131 123 Macroion-macroion correlations in the presence of divalent counterions. Effects of a simple electrolyte B. Hribar and V. Vlachy Faculty of Chemistry and Chemical
UNIVERSITY OF NOVA GORICA GRADUATE SCHOOL SEPARATION OF SMALL MOLECULES ON MONOLITHIC CHROMATOGRAPHIC MATERIALS MASTER'S THESIS.
 UNIVERSITY F NVA GRICA GRADUATE SCHL SEPARATIN F SMALL MLECULES N MNLITHIC CHRMATGRAPHIC MATERIALS MASTER'S THESIS Janez Jančar Mentor: Prof. dr. Aleš Podgornik Nova Gorica, 2013 Abstract In this work,
UNIVERSITY F NVA GRICA GRADUATE SCHL SEPARATIN F SMALL MLECULES N MNLITHIC CHRMATGRAPHIC MATERIALS MASTER'S THESIS Janez Jančar Mentor: Prof. dr. Aleš Podgornik Nova Gorica, 2013 Abstract In this work,
UNIVERZA V LJUBLJANI FAKULTETA ZA FARMACIJO ROK LIPAR MAGISTRSKA NALOGA MAGISTRSKI ŠTUDIJ INDUSTRIJSKE FARMACIJE
 UNIVERZA V LJUBLJANI FAKULTETA ZA FARMACIJO ROK LIPAR MAGISTRSKA NALOGA MAGISTRSKI ŠTUDIJ INDUSTRIJSKE FARMACIJE Ljubljana, 2015 UNIVERZA V LJUBLJANI FAKULTETA ZA FARMACIJO ROK LIPAR OPTIMIZACIJA IZDELAVE
UNIVERZA V LJUBLJANI FAKULTETA ZA FARMACIJO ROK LIPAR MAGISTRSKA NALOGA MAGISTRSKI ŠTUDIJ INDUSTRIJSKE FARMACIJE Ljubljana, 2015 UNIVERZA V LJUBLJANI FAKULTETA ZA FARMACIJO ROK LIPAR OPTIMIZACIJA IZDELAVE
Pojav ostrih konic pri zamrzovanju vodnih kapljic
 Univerza v Ljubljani Fakulteta za matematiko in fiziko Seminar Pojav ostrih konic pri zamrzovanju vodnih kapljic Avtor: Klemen Kelih Mentor: prof. dr. Gorazd Planinšič Ljubljana, 23. september 2013 Povzetek
Univerza v Ljubljani Fakulteta za matematiko in fiziko Seminar Pojav ostrih konic pri zamrzovanju vodnih kapljic Avtor: Klemen Kelih Mentor: prof. dr. Gorazd Planinšič Ljubljana, 23. september 2013 Povzetek
Termodinamika. FIZIKA PSS-GRAD 29. studenog Copyright 2015 John Wiley & Sons, Inc. All rights reserved.
 Termodinamika FIZIKA PSS-GRAD 29. studenog 2017. 15.1 Thermodynamic Systems and Their Surroundings Thermodynamics is the branch of physics that is built upon the fundamental laws that heat and work obey.
Termodinamika FIZIKA PSS-GRAD 29. studenog 2017. 15.1 Thermodynamic Systems and Their Surroundings Thermodynamics is the branch of physics that is built upon the fundamental laws that heat and work obey.
Katastrofalno zaporedje okvar v medsebojno odvisnih omrežjih
 Katastrofalno zaporedje okvar v medsebojno odvisnih omrežjih Daniel Grošelj Mentor: Prof. Dr. Rudi Podgornik 2. marec 2011 Kazalo 1 Uvod 2 2 Nekaj osnovnih pojmov pri teoriji omrežij 3 2.1 Matrika sosednosti.......................................
Katastrofalno zaporedje okvar v medsebojno odvisnih omrežjih Daniel Grošelj Mentor: Prof. Dr. Rudi Podgornik 2. marec 2011 Kazalo 1 Uvod 2 2 Nekaj osnovnih pojmov pri teoriji omrežij 3 2.1 Matrika sosednosti.......................................
VAJE 2: Opisna statistika
 VAJE : Opisna statistika Na računalniških vajah se za urejanje in prikazovanje statističnih podatkov uporabi statistični programski paket SPSS in podatkovna datoteka podatki.sav. NALOGE: 1. Analiza vzorčnih
VAJE : Opisna statistika Na računalniških vajah se za urejanje in prikazovanje statističnih podatkov uporabi statistični programski paket SPSS in podatkovna datoteka podatki.sav. NALOGE: 1. Analiza vzorčnih
