50 th IChO Teoretické úlohy BACK TOWHERE IT ALL BEGAN. 19 th 29 th July 2018 Bratislava, SLOVAKIA Prague, CZECH REPUBLIC
|
|
|
- Pierce Newton
- 5 years ago
- Views:
Transcription
1 19 th 29 th July 2018 Bratislava, SLOVAKIA Prague, CZECH REPUBLIC Teoretické úlohy Krajina: Meno (podľa pasu): Kód študenta: Jazyk: 50 th IChO 2018 International Chemistry Olympiad SLOVAKIA & CZECH REPUBLIC BACK TOWHERE IT ALL BEGAN
2 Pokyny Táto brožúra s teoretickými úlohami má 54 strán. Pracovať môžete začať až keď zaznie pokyn Štart (Start). Na vyriešenie úloh máte 5 hodín. Všetky výsledky a odpovede musia byť jasne a zrozumiteľne napísané perom v prísluchajúcich rámčekoch odpoveďového hárku. Odpovede napísané mimo tohto priestoru nebudú hodnotené. Budú Vám poskytnuté 3 strany pomocného papiera. Ak budete potrebovať viac, použite druhé strany brožúry praktickej skúšky. Nezabúdajte, že všetko uvedené mimo vyznačený priestor nebude hodnotené. Periodická tabuľka a spektrum viditeľného svetla nie sú súčasťou brožúry, dostanete ich zvlášť. Používajte len pero a kalkulačku, ktoré ste dostali. Oficiálna verzia brožúry v anglickom jazyku je k dispozícii na požiadanie a slúži len na objasnenie zadania. Ak potrebujete opustiť laboratórium (použiť toaletu alebo sa občerstviť), zamávajte modrou IChO kartičkou. Bude Vás sprevádzať dozor. Dozor Vás 30 minút pred ukončením časového limitu na túto udalosť upozorní. Keď je vyhlásený príkaz Stop musíte urýchlene prestať pracovať. Ak neprestanete pracovať alebo písať do pol minúty alebo viac po oznámení ukončenia dôjde, za teoretickú časť nezískate žiadne body. Po pokyne Stop vložte svoj odpoveďový hárok naspäť do obálky a počkajte na svojom mieste. Dozor zozbiera obálky. THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 1
3 Fyzikálne konštanty a rovnice Avogadrovakonštanta: Univerzálna plynovákonštanta: Rýchlosť svetla: Planckovakonštanta: Faradayovakonštanta: Štandardný tlak: Normálny (atmosferický)tlak: Nula na Celziovej stupnici: Hmotnosť elektrónu: Atómova hmotnostná jednotka: Ångström: Elektrónvolt: Watt: N A = 6, mol 1 R = 8,314 J K 1 mol 1 c = 2, m s 1 h = 6, J s F = 9, C mol 1 p = 1 bar = 10 5 Pa p atm = 1, Pa 273,15 K m e= 9, kg u = 1, kg 1 Å = m 1 ev = 1, J 1 W = 1 J s 1 Rovnica pre ideálny plyn: Prvý termodynamický zákon: Príkon elektrického spotrebiča: Entalpia: Voľná Gibbsova energia: pv=nrt ΔU=q+W P=UI kde U jenapätie a Ije elektrický prúd H=U+pV G=H TS ΔG o o = RTlnK= zfe cell ΔG=ΔG o +RTlnQ Reakčný kvocient Q pre reakciua A+ b B c C+ d D: Q= [C]c [D] d [A] a [B] b Zmena entropie: Zmena tepla pre tepelne nezávislú c m : ΔS= q rev T kde q rev je teplo pri vratnom deji Δq=nc m ΔT kde c m je mólova tepelná kapacita THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 2
4 Van t Hoffovarovnica: Henderson Hasselbalchovarovnica: ph= pk a +log [A ] [HA] Nernst Petersonova rovnica: dlnk dt = Δ rh m RT 2 ln ( K 2 K 1 ) = Δ rh m R ( 1 T 2 1 T 1 ) E = E o RT zf lnq Energia fotónu: Prepočet medzi E v ev a v J: E= hc λ E ev = E J C q e Lambert Beerova zákon: A=log I 0 I =εlc Vlnočet: ν = ν c = 1 2πc k μ Redukovaná hmotnosť µpre molekulu AX: μ= m Am X m A +m X Energia harmonického oscilátora: E n =hν(n+ 1 2 ) Arrheniova rovnica: k = A e E a RT Integrovaná forma rýchlostných rovníc: Nulový poriadok: Prvý poriadok: Druhý poriadok: [A]=[A] 0 kt ln[a]=ln[a] 0 kt 1 [A] = 1 [A] 0 +kt THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 3
5 Teoretická Úloha 1 7% celkovo Skóre Otázka Total Body Problem 1. DNA Palindromické sekvencie sú zaujímavou skupinou vyskytujúcou sa v DNA. V palindromickej dvojvláknovej DNA (dvojvláknová: double-stranded DNA dsdna), sekvencia jedného vlákna v smere 5 3 je rovnaká ako komplementárneho vlákna tiež v smere 5 3. Teda palindromická dsdna pozostáva z dvoch identických vláken, ktore sú vzájomne komplementárne. Jedným z príkladov je Drew-Dickersonov dodecanukleotid (1): 5 -CGCGAATTCGCG-3 3 -GCGCTTAAGCGC-5 (1) 1.1 Koľko rôznych palindromických dvojváknových DNA dodekanukleotidov (t.j. dsdna pozostávajúca z dvanástich párov) existuje? 1.2 Koľko rôznych palindromických dvojváknových DNA undekanukleotidov (t.j. dsdna pozostávajúca z jedenástich párov) existuje? Teplota topenia dsdna, T m, je definovaná ako teplota, pri ktorej 50 % z pôvodného množstva dvojvláken DNA je disociovaných na jednotlivé vlákna. 1.3 Uvažujte Drew-Dickersonov dodekanukleotid (1). Predpokladajte, že pár báz G-C prispieva k stabilite dvojvlákna viac ako pár báz A-T. Aká je pravdepodobnosť, že jeho T m vzrastie, ak vymeníme jeden náhodne vybraný pár báz novým párom G-C? THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 4
6 Pravdepodobnosť Budeme analyzovať termodynamiku tvorby dvojváknového helixu DNA z jednotlivých vláken, závislosť od dĺžky DNA a od teploty. Rovnovážna konštanta vzniku dsdna z jednotlivých vláken sa líši pre palindromickú a nepalindromickú dsdna. Roztok dsdna so začiatočnou koncentráciou c init= 1, mol dm 3 sa zohrial na T m a ustálila sa rovnováha. 1.4 Pre palindromickú a nepalindromickú DNA vypočítajte rovnovážnu konštantu jej vzniku z jednotlivých vláken pri teplote T m. Nepalindromická dsdna Výpočet: K = Palindromická dsdna Výpočet: THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 5
7 K = Stredný príspevok do Gibbsovej energie vzniku dsdna z dvoch vláken bol určený za rôznych experimentálnych podmienok. Jeho hodota je 6,07 kj mol 1 pre jeden pár G-C a 1,30 kj mol 1 pre jeden pár A-T tvoriacich dsdna. 1.5 Z koľkých bázových párov pozostáva najkratší oligonukleotid dsdna, ktorého T m je nad 330 K? Pri tejto teplote T m sú hodnoty rovnovážnych konštánt vzniku dsdna z jednotlivých vláken: K np = 1, pre nepalindromickú dsdna a K p= 1, pre palindromickú dsdna. Je najkratší oligonukleotid palindromický alebo nepalindromický? Výpočet počtu bázovych párov: Potrebná dĺžka nepalindromickej dsdna: Potrebná dĺžka palindromickej dsdna: Najkratší oligonukleotid je palindromický (P) nepalindromický (NP). THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 6
8 Teraz opustíme ideu individuálnych príspevkov od bázovych párov pri vzniku vláken DNA. Gibbsovu energiu tohto deja môžeme uvažovaťexplicitne/priamo v závislosti od teploty. V grafe je závislosť obrátenej hodoty T m od logaritmu dvojnásobku začiatočnej koncentrácie c init pre Drew- Dickersonov dodekanukleotid. (Poznámka: pri vyjaddrení je použitá štandardná koncentrácia c 0 = 1 mol dm 3 ) c init/ 10 6 mol dm 3 0,25 0,50 1,00 2,0 4,0 8,0 T m/ K 319,0 320,4 321,8 323,3 324,7 326,2 THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 7
9 1.6 Vypočítajte štandardnú entalpiu ΔH a štandardnú entropiu ΔS vzniku DNA z jednotlivých vláken pre palindromický dvojvláknový Drew-Dickersonov dodekanukleotid (1). Predpokladajte, že ΔH aδs nezávisia od teploty. Výpočet: THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 8
10 Teoretická Úloha 2 Otázka Total Body % celkovo Skóre Úloha 2. Návrat telesných pozostatkov do vlasti v stredoveku Pri izbových teplotách je racemizácia pomalou reakciou. Môže byť použitá pre určovanie veku biologických objektov a tiež preštúdium ich teplotnej histórie. Vezmime si ako príklad L- izoleucin(l-ile)((2s,3s)-2-amino-3-metylpentánova kyselina). Ten podlieha izomerizácii na uhlíku a vytvára(2r,3s)-2-amino-3-metylpentánovu kyselinu, známu aj akod-allo-izoleucin. Pretože ku zmene konfigurácie dochádzalen na jednom zo stereogénnych centier, je tento proces lepšie nazývať epimerizácianež racemizácia. 2.1 Označte křížikom všetky správne tvrdenia: D-allo-izoleucin al-izoleucinmajú rovnakú hodnotu špecifickej optickej otáčavosti, ale rôzne body topenia. Hodnota špecifickej optickej otáčavosti D-allo-izoleucinumá rovnakú veľkosť, ale opačné znamienko nežv prípadel-izoleucinu. Bod topenia je rovnaký pre oba izomery. D-allo-izoleucinaL-izoleucinmajú rôznu hodnotu špecifickej optickej otáčavosti, ale rovnaký bod topenia. D-allo-izoleucin al-izoleucinmajú rôzne hodnoty špecifickej optickej otáčavosti a tiež rôzne body topenia. D-allo-izoleucinnie je opticky aktívny 2.2 Priraď absolútnukonfiguráciu každému zo stereoizomérov izoleucinu. 2S,3R (L-allo-izoleucin) 2R,3S (D-allo-izoleucin) 2S,3S (L-izoleucin) 2R,3R (D-izoleucin) THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 9
11 2.3 Rovnovážna konštanta epimerizáce L-izoleucinu K epmá pri teplote 374 K hodnotu 1,38. L-izoleucinupriraďme hodnotu molárnej Gibbsovej energie G m = 0 kj mol 1. Určte molárnu Gibbsovu energiupri teplote 374 K všetkých štruktúr z bodova Dz otázky 2.2. A B C D kj mol 1 kj mol 1 kj mol 1 kj mol Vezmime do úvahy stereoizomériu na všetkých stereogénnych centrách izoleucinu. Aký je maximálny možný počet stereoizomérov v prípade tripeptidu Ile-Ile-Ile? Počet stereoizomérov je Na začiatku epimerizáce je možné zanedbaťspätnú reakciu. Epimerizáciu popíšeme kinetikou prvého poriadku: Hodnota rýchlostnej konštanty tejto reakcie pri 374 K jek 1(374 K) = 9, h 1 a pri 421 K k 1(421 K) = 1, h 1. Vo výpočtoch použite pre koncentráciu L-izoleucinu označenie [L] a pre koncentráciu D-alloizoleucinuoznačenie [D]. Veličina diastereomerný nadbytok de (diastereomeric excess) je definovaný: [L] [D] de = [L] + [D] 100(%). 2.5 VarmeL-izoleucin po dobu hodín pri teplote 374 K. Aká je hodnotade (s presnosťou na tri platné číslice) prel-izoleucin a) pred varením a b) po varení? THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 10
12 a) Pred varením Výpočet: de = % (na 3 platné čísla) b) Po varení Výpočet: de = % (na 3 platné čísla) 2.6 Za ako dlho prebehne konverzia10 % L-izoleucinu nad-allo-izoleucin pri teplote 298 K? Výpočet: THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 11
13 t = rokov V skutočnosti nemôže byť spätná reakcia zanedbaná.správna kinetická schéma je vyjadrená rovnicou Zaveďme veličinu x, ktorá predstavuje rozdiel medzi aktuálnou koncentráciou [L] a rovnovážnou koncentráciou[l] eq (tj. odchylku od rovnováhy) x=[l] [L] eq Pre časový vývoj veličiny x je možné odvodit rovnicu x = x(0) e (k 1 +k 2 )t, kde x(0) predstavuje odchylku od rovnováhy v čase t = 0 h. 2.7 Varme roztok L-izoleucinu s koncentráciou 1,00 mol dm 3 po dobu hodín pri teplote 374 K. Rýchlostna konštanta priamej reakcie má hodnotuk 1(374 K) = 9, h 1, rovnovážna konštanta epimerizácie L-izoleucinu K epmá pri teplote 374 Khodnotu1,38. Vo výpočtoch opäť použite pre koncentráciu L-izoleucinu označenie [L] a prekoncentráciudallo-izoleucinuoznačenie [D].Vypočítajte (s presnosťou na tri platné číslice) a) [L] eq, b) diastereomerný nadbytok (de)po varení. THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 12
14 a) Výpočet: [L] eq = mol dm 3 b) Výpočet: THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 13
15 de =%(na 3 platné čísla) Aminokyseliny s jedným chirálnym centrom podliehajú racemizáci, napr. L-arginin racemizuje podľa schémy: Vývoj koncentrácie v závislosti na čase se riadi rovnicou ln 1+ [D] [L] 1 [D] [L] =2k 1 t+c, kde [D] a [L] sú koncentrácied- al-argininu v časet, k 1 je rýchlostná konštanta a člen Cje výraz obsahujúci začiatočné koncentrácie. Císar Svätejríše rímskej Lothar III. zomrel počas svojho taženia na Sicílii v roku Prezjednodušenie prevozu jeho pozostatkov do vlasti bolo jeho telo hneď po smrti varené po určitú dobu vo vode (pri teplote 373 K). Pokusme sa pomocou chemickej kinetiky odhadnúť dobu varu THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 14
16 jeho tela. Vieme, že rýchlostná konštanta racemizácie argininu v bielkovinách k 1 má pri teplote 373 K a ph = 7 hodnotu 5, h 1. Aby bolo možné analyzovať izomérnezloženie argininu v Lotharových kostiach, bolo nutné začať prevodom argininu do roztoku. Lotharove kosti boli hydrolizované v silne kyslom prostredí po dobu 4 hodin pri teplote 383 K. Podiel koncentrácií optických izomérov [D] bol potom0,090. Telo Lotharovej ženy Richenzy po jej smrti nebolo uvarené. Jej kosti boli hydrolizovanérovnakým spôsobom ako Lotharove a podiel koncentrácií optických izomérov [D] bol potom 0,059. (Poznámka: [L] K racemizácii dochádzaaj behom hydrolýzy a rýchlostna konštanta tejto reakce je k 1 ', ktorá je odlišná od rychlostnej konštanty k 1). 2.8 Ako dlho bolo v roce 1137 telo Lothara III., císara Svätej ríše rímskej, varené vo vode? Poznámka: Racemizácia argininu je extrémne pomalý proces pri teplotách, ktoré sú v hroboch. Protože sú obe tela staré len asi 880 rokov, môžeme zanedbat prirodzenú racemizáciu, ku ktorej došlo behem tejto doby. Výpočet: [L] tvar = h THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 15
17 Otázka Teoretická Úloha 3 8% celkovo Body Skóre Otázka Total Body Skóre Úloha 3. Nástup elektromobilov Súčasné dopravné prostriedky sú založené na spaľovaní fosílnych palív, aj keď účinnosť reálnych spaľovacích motorov je limitovaná a pohybuje se typicky medzi 20 a 40 %. 3.1 Označ krížikom faktory, ktoré môžu zvýšiť účinnosť tepelného stroja: Zvyšenie trenia v mechanických častiach stroja Zvyšenie teploty spaľovania paliva v stroji Zúženie intervalu pracovných teplôt stroja Zvyšenie pracovného tlaku plynu v stroji Palivové články sú jedným zo spôsobov zvyšovania účinnosti motorov pre dopravné prostriedky budúcnosti. Účinnosť motora môže byť zlepšena použitím palivového článku na báze vodíka. 3.2 Štandardnázlučovacia entalpia kvapalnej vody je Δ fh (H 2O,l) = 285,84 kj mol 1. Štandardná spaľovacia entalpiakvapalného izooktanu je Δ ch (C 8H 18,l) = 5 065,08 kj mol 1 (obe hodnoty platia pre teplotu 323,15 K). Vypočítajte hodnoty špecifickej (teda na jednotku hmotnosti) spaľovacej entalpie pri 323,15 K čistého kvapalného izooktanu a čistého plynného vodíka. Δ c H s (C 8 H 18 )= Δ c H s (H 2 )= THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 16
18 3.3 Vypočítajte štandardné elektromotorické napätie (EMF) palivového článku, spaľujúcehoplynný kyslík a vodík, oba plyny považujte za ideálne pri tlaku 100 kpa a teplote323,15 K, pričom produktom je kvapalná voda.pri výpočtepoužite tieto hodnoty entropií, platných pre teplotu323,15 K: S (H 2O,l) = 70 J K 1 mol 1, S (H 2,g) = 131 J K 1 mol 1, S (O 2,g) = 205 J K 1 mol 1. Výpočet: EMF = V 3.4 Vypočítajte ideálnutermodynamickú účinnosť(η) palivového článku produkujúceho kvapalnú vodu pri teplote353,15 K. Pri tejto teplote je zlučovacia entalpia vody Δ fh (H 2O,l) = 281,64 kj mol 1 aodpovedajúca zmena reakčnej Gibbsovej energie Δ rg = 225,85 kj mol 1. η = % 3.5 Elektrolyzér s polymérnou membránou pracuje pri napätí 2,00 V a je vybavený veternou elektrárňou s výkonom 10,0 MW, ktorá bežala na plný výkon od 22:00 do 6:00. Elektrolýzou bolo získane kg čistého vodíka. Vypočítajte výťažok elektrolýzy definovanú ako pomer hmotnosti vyprodukovaného vodíka a maximálneho teoreticky vyprodukovateľného množstva (hmotnosti) vodíka. Výpočet: THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 17
19 η elektrolýza = % 3.6 Vypočítajte hmotnosť vodíka potrebného k prekonaniu vzdialenosti mezi Prahou a Bratislavou (330 km) priemernou rýchlosťou100 km h 1 autom vybaveným elektromotorom s výkonom 310 kw, ktorý beží na 15 % svojho maximálneho výkonu. Predpokladajte, že účinnosť vodíkového palivového článku, produkujúceho elektrickú energiu, je 75 % a účinnosť elektromotora je 95 %. Zmena reakčnej Gibbsovej energie spaľovania vodíkaje Δ rg = 226 kj mol 1. Výpočet: m = kg Nízká účinnosť pri produkcii vodíka a bezpečnostnéproblémy spojené s jeho skladovaním zbrzdily rozšírenie dopravných prostriedkov založených na spaľovaní vodíka. Hydrazinové (N 2H 4) palivové články by mohly byť vhodnou alternativou. THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 18
20 Máte k dispozícii následujúce štandardné redukčné potenciály vodných systémov hydrazinu: N 2(g) + 5 H + (aq) + 4 e N 2H 5+ (aq) E = 0.23 V N 2H 5+ (aq) + 3 H + (aq) + 2 e 2 NH 4+ (aq) E = V N 2(g) + 4 H 2O(l) + 4 e N 2H 4(aq) + 4 OH (aq) E = 1.16 V N 2H 4(aq) + 2 H 2O(l) + 2 e 2 NH 3(aq) + 2 OH (aq) E = V 2 H 2O(l) + 2 e H 2(g) + 2 OH (aq) E = 0.83 V. 3.7 Do nasledujúcich Latimerových diagramov doplňte formy hydrazinu a amoniaku, ktoré prevládaju za daných podmienok, spolu s hodnotami redoxných potenciálov príslušných danej elektrochemickej poloreakcii (do rámečekov ku šípkam). Uveďte všetky potrebné výpočty. a) Kyslé prostredie (ph = 0) N 2 b) Zásadité prostredie (ph = 14) N 2 Výpočet: Kvôli toxicite, zápachu a dopadu na životné prostredie je produkcia amoniaku v palivových článkoch veľminepriaznivá. THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 19
21 3.8 Napíšte celkovú reakciu rozkladu hydrazinu v zásaditom prostredí na (i) amoniak a dusík, a (ii) dusík a vodík,a vypočítajte zodpovedajúcu rovnovážnu konštantu pri teplote298,15 K. Chemické rovnice rozkladu hydrazinu: Výpočet: Rozklad hydrazinu na NH 3 a N 2v zásaditom prostredí: K = Roklad hydrazinu na H 2 a N 2v zásaditom prostredí: K = Nabíjateľné články na báze lítiasú alternatívou k palivovým článkom. V lítium-iónových bateriachje jedna z elektród obvykle vyrobena z grafitu, medzi jeho vrstvy súvložené klastre lítia. Druhá elektróda je vyrobena zoxidu lítia a kobaltu, který umožňuje vratnú absorpciu lítnych iónov putujúcich z jednej elektrody na druhúpočas nabíjania a vybíjania. Poloreakcie príslušných systémov môžu byť formálne napísane ako: (C) n + Li + + e Li(C) n E = 3.05 V, CoO 2 + Li + + e LiCoO 2 E = V. 3.9 Za použitia vyššie uvedeného formalismu, zapíšte celkovú chemickú reakciu, která prebieha v baterii behom jejvybíjania. Určte oxidačné čísla kobaltu. THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 20
22 3.10 Zaškrtni políčka, u ktorých je správne tvrdenie platné pre vybíjanie lítium-iónovej baterie popísanej v otázke 3.9: Li(C) n elektróda je katóda, pretože súna nej redukované lítne ióny. anóda, pretože súna nej oxidované atómy lítia. LiCoO 2 elektróda je katóda anóda pretože súna nej redukované ióny kobaltu. pretože súna nej oxidované ióny kobaltu Predpokladajte, že častice C 6, častice CoO 2aatóm Li vytvárajú aktívny materiál baterie potrebný pre prenos jedného elektrónu medzi elektródami.za použitiazodpovedajúceho štandardného elektromotorického napätia EMF,vypočítajte teoretickú špecifickú vratnú nabíjaciu kapacitu (c q,s, v jednotkách mah g 1 ) ašpecifickú hustotu energie (ρ el, v jednotkách kwh kg 1 ) takejto modelovej lítium-iónovej baterie prislúchajúcej k celému aktívnemu materiálu baterie. Výpočet: Nabíjacia kapacita (c q,s ) = mah g 1 Výpočet: Hustota energie (ρ el )= kwh kg 1 THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 21
23 Teoretická Úloha 4 6% celkovo Skóre Otázka Total Body Problém 4. Kolónovachromatografia rádioaktívnej medi 64 Cu pre pozitrónovú emisnú tomografiu je pripravovaná bombardovaním zinkového terča (atómu zinku) jadrom deutéria. (ďalej nazývaný ako aktivovaný terč). 4.1 Zapíšte vyčíslenú rovnicu bombardovania jadra 64 Zn jadrami deutéria, za vzniku 64 Cu. Špecifikujte odpovedajúce atómové a hmotnostné čísla všetkých špécií. Ignorujte náboje špécií. + + Aktivovaný terč je rozpustený v kyseline chlorovodíkovej[hcl (aq)] za vzniku zmesi obsahujúcej Cu 2+ a Zn 2+ ióny a ich príslušné chlorido komplexy. 4.2 Vypočítajte mólový zlomok negatívne nabitých špécií medi s ohľadom na množstvo medi pripravenej pri aktivácii terčového zinku. Predpokladajte [Cl ] = 4 mol dm 3. Celkové konštanty stability komplexov, β, si pozrite vtabuľke 1. Skôr ako začnete počítať, zapíšte náboje do rámčekov vpravo hore: Cu [CuCl] [CuCl2] [CuCl3] [CuCl4] Tabuľka 1. Celkové konštanty stability β špécií Cu (vo vzorcoch boli vynechané náboje). β i = [CuCl i ] [Cu] [Cl] i i v [CuCl i] β i 2,36 1,49 0,690 0,055 THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 22
24 Výpočet: Mólový zlomok = (výsledok uveďte na 2 desatinné miesta) Zmes obsahujúca Cu 2+ a Zn 2+ ióny a ich príslušné chlorido komplexy bola separovaná na aniónovom iónomeniči. Suchý iónomenič v OH cykle bol dispergovaný vo vode a vzniknutá suspenzia bola prenesená do kolóny. Pre naviazanie Cl iónov na všetky výmenné miesta (t.j. získanie iónomeničav Cl cykle), bol iónomenič prepláchnutý kyselinou chlorovodíkovou a potom deionizovanou vodou,aby sa odstránili všetky nenaviazané Cl ióny. 4.3 Pred premytím kyselinou chlorovodíkovou malo všetkolaboratórnu teplotu. Zmenila sa teplota kolóny počas premývania kyselinou chlorovodíkovou? Nie. Áno, teplota sa znížila. Áno, teplota sa zvýšila. Zmes obsahujúca Cu 2+ a Zn 2+ ióny a ich príslušné chlorido komplexy bola prenesená do kolóny naplnenej iónomeničom. Kyselina chlorovodíková bola následne použitá ako elučné činidlo. Pomocou jednoduchého experimentálneho vzťahu je možné vypočítať priemerné elučné vlastnosti špécií medi a zinku v kolóne. Retenčný objem V R (objem mobilnej fázy, pri ktorom je 50% zlúčeniny vyeluovenej z kolóny) môže byť vypočítaný nasledovne: V R = D g m resin,dry,oh form + V 0 THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 23
25 4.4 Použitím priemerných hmotnostných distribučných koeficientov D g (D g(cu špécie) = 17,4 cm 3 g 1, D g(zn špécie) = 78,5 cm 3 g 1 ), vypočítajte retenčné objemy V Rv cm 3 obidvoch špécii medi a špécií zinku ak hmotnosť suchého iónomeniča v OH cyklem resin,dry,oh form = 3,72 g a mŕtvy objem kolóny V 0 = 4,93 cm 3. Výpočet: V R(špécie Cu) = V R(špécie Zn) = cm 3 (výsledok uveďte na 1 desatinné mesto) cm 3 (výsledok uveďte na 0 desatinných miest) Ak neviete zistiť odpoveď, pre ďalšie výpočty použite hodnoty V R(špécie Cu) = 49,9 cm 3 a V R(špécie Zn) = 324 cm 3. Použitím jednoduchého experimentálneho vzťahu je možné separáciu dvoch zložiek A a B považovať za kompletnú, pokiaľ V 0.001(A) V 0.999(B) > 10V c kde V je objem mobilnej fázy, priktorom 0,1% zložky A bolo eluované z kolóny, a V je objem mobilnej fázy, priktorom 99.9% zložky B bolo eluované z kolóny. V (A) = V R (A) ( d p /L c ) V (B) = V R (B) ( d p /L c ) V (B)= 2V R (B) V (B) 4.5 Na základe výpočtov rozhodnite, či boli špécie medi kompletne separované od špécií zinku. Objem kolóny naplnenejnapučaným iónomeničom je V c = 10,21 cm 3, priemer častice iónomeniča je d p = 0,125 mm, a výška zmáčanéhoiónomeniča v napučanom stave je L c = 13,0 cm. V 0.001(A) = cm 3 V 0.999(B) = cm 3 Špécie medi je možné separovať od špécií zinku. Správne Nesprávne THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 24
26 4.6 Vypočítajte hodnotu celkovej teoretickejiónovovýmenej kapacity suchého iónomeniča použitého v tejto úlohe Q m,teor v mmol g 1.Predpokladajte, že za iónovú výmenu iónomeniča boli zodpovedné lentetraalkylamónne skupiny. Žiadne iné skupiny obsahujúce dusík neboli prítomné. Hmotnostný zlomok dusíka v suchom iónomeniči bol 4,83%. Q m,teor = mmol g 1 (výsledok uveďte na 2 desatinné miesta) Ak nemôžete zistiť odpoveď, pre ďalšie výpočty použite Q m,teor = 4,83 mmol g 1. V skutočnosti sa na iónovej výmene nezúčastňujú všetky tetraalkylamónne skupiny. Pre stanovenie celkovejiónovovýmenej kapacity Q v bola kolóna, naplnená 3,72 g suchého iónomeniča prevedená do Cl cyklu, premytá roztokom obsahujúcim nadbytok síranu sodného. Vyeluovaný roztok (efluent) bol zachytávaný do 500 cm 3 odmernej banky, ktorá bola následne doplnená po rysku deionizovanou vodou. Alikvotná časť 100 cm 3 bola potenciometricky titrovaná 0,1027 mol dm 3 roztokom dusičnanu strieborného. Spotreba dusičnanu strieborného v bode ekvivalencie bola 22,20 cm 3. Objem kolóny naplnenejnapučanýmiónomeničomv c bol 10,21 cm Vypočítajte Q vnapučaného iónomeniča v mmol na cm 3 aktívnychtetraalkylamónnych skupín. Q v = mmol cm 3 (výsledok uveďte na 2 desatinné miesta) Ak neviete zistiť odpoveď pre ďalšie výpočty použite Q v = 1,00 mmol cm Vypočítajte mólový zlomok (x) tetraalkylamónnych skupín, ktoré sa aktívne zúčastňujúna iónovej výmene. x = (výsledok uveďte na 3 desatinné miesta) THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 25
27 Otázka Teoretická Úloha 5 8% celkovo Body Skóre Otázka Total Body Skóre Problem 5. Český granát Český granát (pyrop) je známy polodrahokam krvavočervenej farby. Chemické zloženie prírodného granátu je vyjadrené všeobecným stechiometrickým vzorcom A 3B 2(SiO 4) 3,kde A II je dvojmocný katión a B III je trojmocný katión. Granáty majú kubickú základnú bunku, ktorá obsahuje 8 jednotiek uvedeného všeobecného vzorca. V štruktúre sú 3 typy polyédrov: katión A II obsadzuje dodekaédricku pozíciu (je obklopený ôsmymi atómami O), katión B III obsadzuje oktaédricku pozíciu (je obklopený šiestimi atómami O) a Si IV je obklopený štyrmi atómami O tvoriacimi tetraéder. Najbežnejším granátom je almandín, ktorý má vzorec Fe 3Al 2(SiO 4) 3. Veľkosť základnej bunky je a = 11,50 Å. 5.1 Vypočítajte teoretickú hustotu almandínu. = g cm 3 Český granát má zloženie Mg 3Al 2(SiO 4) 3.Čistá zlúčenina je bezfarebná a farba prírodného granátu pochádza z chromofórov katióny prechodných kovov nahradzujú katióny pôvodného materiálu. Červená farba českého granátu pochádza zo stopových množstiev iónov Cr III v oktaédrickych pozíciach a iónov Fe II v dodekaédrickych pozíciach. 5.2 Načrtnite diagram štiepenia pre [Cr III O 6] oct d-orbitály a obsaďte ho elektrónmi. THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 26
28 5.3 Určte prvok(ky) z 1.periódy prechodných kovov, ktorého trojmocný katión M III v oktaedrickej pozíciije diamagnetický v prípade nízkospinového usporiadania a paramagnetický v prípade vysokospinového usporiadania. 5.4 Na obrázku je štiepenie d-orbitálov v dodekaedrickom kryštálovom poli. Vyznačte obsadenie hladín elektrónmi v prípade chromofóru [Fe II O 8] dod pre obe existujúce usporiadania. a) vysokospinové usporiadanie b) nízkospinové usporiadanie 5.5 Odvoďte nerovnosti (napr. P<E 1 + E 2 + E 3) pre hodnoty energií spárovania elektrónov (P) vo vzťahu k energiám E 1, E 2 a E 3 pre obe usporiadania. a) vysokospinové usporiadanie: P b) nízkospinové usporiadanie: P 5.6 Za predpokladu, že P>E 3, určte prvok(ky)z 1. periódy prechodných kovov, ktorého dvojmocný katión M II v dodekaédrickej pozícii je diamagnetický v nízkospinovom usporiadaní a paramagnetický vo vysokospinovom usporiadaní. THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 27
29 Absorbance Absorbance Absorbance Absorbance INTERNATIONAL CHEMISTRY OLYMPIAD / SLOVAKIA &CZECH REPUBLIC, 2018 Nasledujúce obrázky znázorňujú jednoduché absorpční spektra štyroch farebných minerálov krvavočerveného českého granátu, zeleného uvarovitu, modrého safíru a žlto-oranžového citrínu. A B λ (nm) λ (nm) C D λ (nm) λ (nm) 5.7 Priraďte spektra k minerálom. Český granát: Uvarovit: Safír: Citrín: 5.8 Ako sa bude javit český granát ožiarený monochromatickým modro-zeleným (blue-green) svetlom? Red Blue Yellow-orange Black Yellow Blue-green Violet White Andradit je ďalší granátový minerál; jeho chemické zloženie je Ca 3Fe 2(SiO 4) 3. Dvojitou náhradou kationu Ti IV za Fe III v oktaedrickejpozícii a Fe III za Si IV v tetraedrickej pozícii získame čierny schorlomit. Jeho chemické zloženieje vyjadrené ako Ca 3 [Fe,Ti] oct 2 ([Si,Fe] tet O 4 ) 3. THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 28
30 5.9 Vypočítajte percentuálne zastúpenie Si IV iónov vo vzorke schorlomitu, které musí byť nahradené Fe III ak viete, že 5% Fe III iónov v oktaedrickej pozícii je nahradené Ti IV. p = % Farba minerálu je zpôsobená dvoma chromofórmi: [Fe III O 6] oct a [Fe III O 4] tet. Centráne ióny oboch chromofórov majúrovnaký počet nespárovaných elektrónov Načrtnite diagram štiepenia d-orbitálov pre oba chromofóry a doplňte elektróny. [Fe III O 6] oct : [Fe III O 4] tet : Tetraedrické pole zpôsobuje menšierozštiepenie než oktaedrické pole ( tet = 4 9 oct). Prekvapujúco je pre ióny Fe III energia prvného d-d přechodu (i keď velmi slabého) pre oktaedrický chromofor menšia ( cm 1 ) než pre tetraedrický ( cm 1 ) Vypočítajte veľkosť energie spárovania elektrónov (P) a veľkosť Δ oct a Δ tet štiepenia. Predpokladajte, že energie spárovania elektrónovsú rovnaké pre oba chromofory. P = Δ oct = Δ tet = cm 1 cm 1 cm 1 THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 29
31 Syntetický granát YAG (YttriumAluminiumGarnet) používaný v optoelektronike má zloženie Y 3Al 5O 12. Jeho štruktúra je odvodená zo všeobecnej štruktury granátu A 3B 2(SiO 4) 3 umiestnením iónov Y III a Al III do polôh A, B a Si Na základe vašich znalostí o relativních polomeroch iónovrozhodnite, ktorý katión obsadí ktorú pozíciu. A: B: Si: 5.13 Pre využitie v LED technológiach je YAG dopovaný Ce III. Určte hodnoty x a y vo vzorci YAG, v ktorom je 5% atómov ytria nahradené atómami céru. Y xce yal 5O 12 x = y = Ak úlohu neviete vyriešiť, pre ďalšie výpočty použite hodnotu x = 2,25 a y = 0, YAG dopovaný Ce III je pripravový žíháním Y 2O 3, Al 2O 3 a CeO 2 vo H 2 atmosfére. Použitím vzorca z otázky 5.13 zapíšte vyčíslenu rovnicu pre túto reakciu s najmenšími celočíselnými stechiometrickými koeficientmi. THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 30
32 Dopovanie YAG štruktúry iónmi kovov vzácnych zemín umožňuje výrobu laserov s emisnými vlnovými dĺžkami v rozsahu od UV po blízku IR oblasť. V schéme sú zjednodušene znázornené energetické f f prechody vybraných iónov kovov alkalických zemín Ktorý katión má prechod zodpovedajúci emisi modrého svetla? Er 3+ Sm 3+ Tm 3+ Pr 3+ Yb 3+ Nd 3+ Tb Vypočítajte vlnovú dĺžku tohto žiarenia. λ = nm 5.17 Podľa legendy použil Noe na svietenie behom svojej plavby palicu s granátom. Určte farbu laserového lúča emitovaného z jeho palice, ak bol granátomkrvavočervený český granát. Uvažujte iba fotoluminiscenčný efekt. červená modrá žlto-oranžová čierna žltá modro-zelená fialová biela THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 31
33 Teoretická Úloha 6 7% celkovo Skóre Otázka Celkom Body Problém 6. Hurá na huby! Zbieranie húb patrí medzi tradičné české a slovenské koníčky. Zatiaľčo niektoré naše druhy húb sú jedlé, iné sú nejedlé, alebo dokonca jedovaté. Hnojník atramentový (Coprinopsis atramentaria) je považovaný za jedlý a chutný. Obsahuje zlúčeninu nazývanú koprin, ktorá sa jednoducho syntetizuje z etyl 3-chlórpropanoátu (1). 6.1 Nakreslite vzorce zlúčenín A E (vrátane stereochemického usporiadania, pokiaľ je prítomné). Pomôcka: Prvá reakcia, pri ktorej vzniká zlúčenina A, prebieha cez organokovový medziprodukt, ktorý potom cyklizuje. A B C D E THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 32
34 Koprin podlieha v ľudskom tele hydrolýze na kyselinu L-glutámovú (3) a na zlúčeniny C a 4, ktorésú zodpovedné za vedľajšie účinky koprinu. Tieto zlúčeniny inhibujú enzým acetaldehyddehydrogenázu, ktorý sapodieľa nametabolizme alkoholu. Pokiaľ je enzým inhibovaný, acetaldehyd vytvorený alkoholdehydrogenázou sa hromadí v tele a spôsobuje ťažké symptómy kocoviny (tzv. antabusový efekt). Aktívne centrum enzýmu obsahuje cysteinovú -SH skupinu, ktorá je blokovaná zlúčeninou C alebo 4. Enzym = acetaldehyddehydrogenáza 6.2 Pomocou piktogramu pre acetaldehyddehydrogenázu zobrazeného vyššie nakreslite štruktúru F pre enzým inhibovaný zlúčeninou 4. F Pomenovanie antabusový efekt vzniklo podľa názvu antabusu (5), najznámejšieho liečiva používaného na liečbu závislosti na alkohole. Toto liečivo môže byť syntetizované podľa nasledujúcej schémy. THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 33
35 6.3 Nakreslite vzorce zlúčenín G a H. Pomôcka: Zlúčenina H obsahuje päť atómov uhlíka. G H 6.4 Z nasledujúceho zoznamu označte všetky možné činidlá, ktoré môžu byť použité ako činidlo I. m-chlórperoxobenzoová kyselina (m-cpba) zriedený H 2O 2 Zn/CH 3COOH NaBH 4 I 2 horúca koncentrovaná H 2SO 4 K 2CO 3, H 2O AlCl 3 Spôsobakým antabus inhibuje acetaldehyddehydrogenázu je podobný akopri zlúčenináchc a 4. enzym = acetaldehyddehydrogenáza 6.5 Použitím piktogramu pre acetaldehyddehydrogenázu zobrazeného vyššie nakreslite štruktúru J enzýmu inhibovaného antabusom (5). Pomôcka: V štruktúre by mali byť tri atómy síry. J Ušiak obyčajný (Gyromitra esculenta) je ďalšou zaujímavouhubou. Aj keď bola v minulosti poväzovaná za jedlú (esculentus v latinčine znamená jedlý), bolo jednoznačne dokázané, že táto THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 34
36 huba je vzhľadom na prítomnosť gyromitrinu(m)jedovatá. Táto prírodná látka môže byť pripravenáz N-metylhydrazínu (6): 6.6 Nakreslite vzorce zlúčenín K M. K L M V ľudskom tele gyromitrin (M) hydrolyzuje a poskytuje N-metylhydrazín (6), ktorý je silne hepatotoxický. Akonáhle sa gyromitrin (M) dostane do kyslého prostredia žalúdka, začne hydrolýza, pri ktorej sú obe (amidová a iminová) skupiny hydrolyzované. Zamerajme sa na hydrolýzu amidovej skupiny v molekule gyromitrinu. Vlnočet valenčnej vibrácie príslušnej C N väzby je 1293,0 cm -1 a potenciálna energia povrchu nie je signifikantne ovplyvňovaná substitučným izotopovým efektom. 6.7 Vypočítajte najvyšší možný hypotetický kinetický izotopový efekt pri teplote ľudského tela37 C pre uvedenú hydrolýzu, za predpokladu, že tak ako relevantný atóm uhlíka, tak aj dusíka, sú súčasne vymenené. 14 N za 15 N izotop a 12 C za 13 C izotop. Uvažujte, že rýchlostnú konštantu ovplyvňuje len vibračná energia nulového bodu. Predpokladajte, že mólové hmotnosti všetkých izotopovsú celé čísla. Vo všetkých ďalších krokoch použite päť platných číslic. THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 35
37 6.8 Po realizácii tejto izotopovej výmeny však rýchlosti hydrolýzy nie sú signifikantne rozdielne. Ktorý z nižšie uvedených krokov je najpravdepodobnejší rýchlosť určujúci faktor? Nukleofilný atak vody na protonizovanúamidovúskupinu Rozštiepenie C N väzby Protonizácia molekuly gyromitrinu THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 36
38 Teoretická Úloha 7 7 % celkovo Skóre Otázka Celkom Body Úloha 7. Cidofovir Cidifovir (1), pôvodne navrhnutý a pripravený skupinou prof. Holého v bývalom Československu, je nukleotidový analóg s antivírusovou aktivitou. Je používaný na liečbu vírusových infekcií, predovšetkým pacientov s AIDS. Kľúčovým medziproduktom pri jeho syntéze je opticky čistý diol 2, ktorý môže byť pripravený z L- manitolu (L-mannitol) (3). THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 37
39 7.1 Nakreslite štruktúry zlúčenín A D vrátanestereochémie. Jedna molekula A poskytuje dve molekuly B. A C 12H 22O 6 B C D 7.2 Nakreslite štruktúry všetkých ďalších stereoizomérov zlúčeniny 3, ktoré môžu byť použité v tej istej reakčnej sekvencii za tvorby iba toho istého produktu 2. THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 38
40 Diol 2 je ďalej modifikovaný za vzniku zlúčeniny I. Syntéza fosfonátu 4 použitého pri reakcii zlúčeniny F na G bude diskutovaná neskôr. THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 39
41 7.3 Nakreslite štruktúry zlúčenín E I vrátane stereochémie. Použite skratku MMT pre(4- metoxyfenyl)difenylmetylovú skupinu. Tá istá schéma ako na predchádzajúcej strane slúži lenpre jednoduchšiu orientáciu. E C 30H 30O 4 F G H I C 16H 27O 8PS THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 40
42 Fosfonát 4 môže byť pripravený podľa nasledujúcej schémy: 7.4 Nakreslite štruktúry zlúčenín J L. J K L Reakcia I (z otázky 7.3) s cytozínom (cytosin) (5) poskytuje zmes izomérovm a N v pomere 3:1. Vznik týchto dvoch produktov môže byť objasnený uvedomením si, že cytozín (5) môžeexistovať tiež ako aromatický tautomér P. Reakcia M s cyklohexa-1,4-diénom a hydroxidom paladnatým na uhlí poskytuje zlúčeninu O. Fosfonátová esterováskupinav zlúčenine O reaguje s brómtrimetylsilánom za vzniku cidifoviru (1). THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 41
43 7.5 Nakreslite štruktúry dvochizomérovm, N a zlúčeniny O vrátane stereochémiea štruktúru aromatického tautoméru P cytozínu (5). TransformáciaM na O je odstráneniechrániacej skupiny. M (75%) N (25%) THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 42
44 O P 7.6 Nakreslite štruktúry dvoch jednoduchých organických vedľajších produktovq a R, ktoré vznikajú pri reakcii M na O. Q z cyklohexadiénu R z chrániacej skupiny THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 43
45 Teoretická Úloha 8 9 % celkovo Skóre Otázka Celkom Body Problém 8. Karyofylén ß-Karyofylén ( -Caryophyllene) (3) je prirodzene sa vyskytujúci seskviterpén prítomný v klinčeku a v niektorých tradičných českých a slovenských rastlinách, ako je napríklad rastlina chmeľu alebo lipa malolistá. Syntéza ß-karyofylénu sa začína z jednoduchého enantioméru dienónu A. Reakcia A so silylketénacetálom 1 je nasledovaná okamžitou redukciou a spracovanie vodou umožňuje ketón 2. Tento medziprodukt sa potom následne podrobí reakcii s tosylchloridom, čím sa získa B. Cyklizácia tejto zlúčeniny poskytuje C. Nakoniec reakcia C s ylidom D poskytuje karyofylén. THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 44
46 8.1 Nakreslite štruktúry zlúčenín A - D vrátane príslušnej stereochémie. Pomôcka: Pri transformácii A 2 silylketénacetal pôsobí ako nukleofil. A C 10H 14O B THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 45
47 C D Jedna z dvojitých väzieb v 2 ale aj v 3 má trans konfiguráciu a vzhľadom na veľký rozmer kruhu je kostra dostatočne stabilná. Trans-cyklooktén (4) je najmenší kruh, ktorý môže obsahovať trans dvojitú väzbu. Môže sa pripraviť podľa nasledujúcej schémy: 8.2 Nakreslite štruktúru činidla E a medziproduktov F a G vrátane príslušnej stereochémie. Pre F a G začiarknite políčko označujúce stereochemický výsledok. E F achirálny jednoduchý enantiomér racemická zmes zmes diastereoizomérov THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 46
48 G achirálny jednoduchý enantiomér racemická zmes zmes diastereoizomérov THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 47
49 8.3 Nakreslite štruktúru enantioméru cykloalkénu 4. Dve dvojité väzby v -karyofyléne vykazujú rôznu reaktivitu: v dôsledku pnutia je dvojitá väzba v kruhu (endocyklická) reaktívnejšia ako druhá (exocyklická). 8.4 Nakreslite štruktúry zlúčenín Ha + Hb, I a Ja + Jb vrátane príslušnej stereochémie. Pomôcka: Ha+ Hb a Ja + Jb sú dvojice diastereomérov. THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 48
50 Ha + Hb I Ja + Jb THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 49
51 Je zaujímavé, že keď sa namiesto -karyofylénu (3) použije izokaryofylén (5) je reaktivita dvojitých väzieb obrátená. 8.5 Nakreslite štruktúry zlúčenín Ka a Kb. Pomôcka: Ka + Kb je dvojica stereomérov. Ka + Kb Izotopovo značené zlúčeniny sú neoceniteľnými nástrojmi pre skúmanie reakčných mechanizmov, stanovenie štruktúry a hmotnostnú alebo NMR spektroskopiu. Pozrime sa teda na syntézu niektorých značených analógov -karyofylénu. THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 50
52 8.6 Nakreslite štruktúry zlúčenín L a Mvrátane stereochémie, ak je to opodstatnené. L M C 14H 20D 2O -karyofylén (3) podlieha kyselinou katalyzovanej cyklizácii, čo vedie ku vzniku komplexnej zmesi produktov. Medzi nimi sú najrozšírenejšie dvojice diastereomérov Na + Nb a 7a + 7b. Reakcia začína protonizáciou reaktívnejšej vnútornej dvojitej väzby poskytujúcej katión O. Ten sa cyklizuje bez štiepenia jednoduchej väzby uhlík-uhlík, čím sa získajú diastereomérne tricyklické katióny Pa a Pb, ktoré sa podrobia hydratácii za vzniku cieľových alkoholov Na a Nb. Alternatívne sa katióny Pa a Pb preusporiadajú štiepením jednoduchej väzby uhlík-uhlík na katióny Qa a Qb, ktoré sa deprotonizujú na zlúčeniny 7a a 7b. THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 51
53 8.7 Nakreslite štruktúry troch medziproduktov O, Pa, Qa vedúcich k diastereoméru 7a, vrátanestereochémie, ak je to opodstatnené. O Pa Qa 8.8 Nakreslite štruktúry diastereomérov Na + Nb. Na + Nb C 15H 26O THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 52
54 THEORETICAL PROBLEMS, OFFICIAL ENGLISH VERSION 53
3 points in total correct molar mass 1 point, correct equation 1 point, correct numerical calculation starting from correct equation 1 point
 Problem 5. Bohemian garnet Bohemian garnet (pyrope) is a famous Czech blood coloured semi-precious stone. The chemical composition of natural garnets is expressed by the general stoichiometric formula
Problem 5. Bohemian garnet Bohemian garnet (pyrope) is a famous Czech blood coloured semi-precious stone. The chemical composition of natural garnets is expressed by the general stoichiometric formula
50 th IChO 2018 THEORETICAL PROBLEMS BACK TO WHERE IT ALL BEGAN. 19 th 29 th July 2018 Bratislava, SLOVAKIA Prague, CZECH REPUBLIC
 19 th 29 th July 2018 Bratislava, SLOVAKIA Prague, CZECH REPUBLIC www.50icho.eu THEORETICAL PROBLEMS Country: Name as in passport: Student code: Language: 50 th IChO 2018 International Chemistry Olympiad
19 th 29 th July 2018 Bratislava, SLOVAKIA Prague, CZECH REPUBLIC www.50icho.eu THEORETICAL PROBLEMS Country: Name as in passport: Student code: Language: 50 th IChO 2018 International Chemistry Olympiad
Od zmiešavacieho kalorimetra k ultra citlivej modulovanej kalorimetrii. Jozef Kačmarčík
 Od zmiešavacieho kalorimetra k ultra citlivej modulovanej kalorimetrii CENTRUM FYZIKY VEĽMI NÍZKYCH TEPLÔT Ústavu experimentálnej fyziky SAV a Univerzity P.J.Šafárika Centrum excelentnosti SAV Jozef Kačmarčík
Od zmiešavacieho kalorimetra k ultra citlivej modulovanej kalorimetrii CENTRUM FYZIKY VEĽMI NÍZKYCH TEPLÔT Ústavu experimentálnej fyziky SAV a Univerzity P.J.Šafárika Centrum excelentnosti SAV Jozef Kačmarčík
50 th IChO 2018 THEORETICAL PROBLEMS BACK TO WHERE IT ALL BEGAN. 19 th 29 th July 2018 Bratislava, SLOVAKIA Prague, CZECH REPUBLIC
 19 th 29 th July 2018 Bratislava, SLOVAKIA Prague, CZECH REPUBLIC www.50icho.eu THEORETICAL PROBLEMS Country: Name as in passport: Student code: Language: 50 th IChO 2018 International Chemistry Olympiad
19 th 29 th July 2018 Bratislava, SLOVAKIA Prague, CZECH REPUBLIC www.50icho.eu THEORETICAL PROBLEMS Country: Name as in passport: Student code: Language: 50 th IChO 2018 International Chemistry Olympiad
CHEMICKÉ VÝPOČTY VO VŠEOBECNEJ A ANORGANICKEJ CHÉMII
 CHEMICKÉ VÝPOČTY VO VŠEOBECNEJ A ANORGANICKEJ CHÉMII Ivan Potočňák Prírodovedecká fakulta Košice 07 Univerzita Pavla Jozefa Šafárika v Košiciach Prírodovedecká fakulta Chemické výpočty vo všeobecnej a
CHEMICKÉ VÝPOČTY VO VŠEOBECNEJ A ANORGANICKEJ CHÉMII Ivan Potočňák Prírodovedecká fakulta Košice 07 Univerzita Pavla Jozefa Šafárika v Košiciach Prírodovedecká fakulta Chemické výpočty vo všeobecnej a
50 th IChO 2018 THEORETICAL PROBLEMS BACK TO WHERE IT ALL BEGAN. 19 th 29 th July 2018 Bratislava, SLOVAKIA Prague, CZECH REPUBLIC
 19 th 29 th July 2018 Bratislava, SLOVAKIA Prague, CZECH REPUBLIC www.50icho.eu THEORETICAL PROBLEMS Country: Name as in passport: Student code: Language: 50 th IChO 2018 International Chemistry Olympiad
19 th 29 th July 2018 Bratislava, SLOVAKIA Prague, CZECH REPUBLIC www.50icho.eu THEORETICAL PROBLEMS Country: Name as in passport: Student code: Language: 50 th IChO 2018 International Chemistry Olympiad
Analytická chémia I. Analytické meranie. Princípy analytických meraní 2/13/2018
 Analytická chémia I 2017/2018 prof. Ing. Ivan Špánik, DrSc. Ústav Analytickej chémie miestnosťč. 490, 566, 379 Klapka 283 e-mail: ivan.spanik@stuba.sk Analytické meranie Signál Dekódovanie Vzorka Informácia
Analytická chémia I 2017/2018 prof. Ing. Ivan Špánik, DrSc. Ústav Analytickej chémie miestnosťč. 490, 566, 379 Klapka 283 e-mail: ivan.spanik@stuba.sk Analytické meranie Signál Dekódovanie Vzorka Informácia
Advanced Placement. Chemistry. Integrated Rates
 Advanced Placement Chemistry Integrated Rates 204 47.90 9.22 78.49 (26) 50.94 92.9 80.95 (262) 52.00 93.94 83.85 (263) 54.938 (98) 86.2 (262) 55.85 0. 90.2 (265) 58.93 02.9 92.2 (266) H Li Na K Rb Cs Fr
Advanced Placement Chemistry Integrated Rates 204 47.90 9.22 78.49 (26) 50.94 92.9 80.95 (262) 52.00 93.94 83.85 (263) 54.938 (98) 86.2 (262) 55.85 0. 90.2 (265) 58.93 02.9 92.2 (266) H Li Na K Rb Cs Fr
8. Relax and do well.
 CHEM 1515 Exam II John II. Gelder October 14, 1993 Name TA's Name Lab Section INSTRUCTIONS: 1. This examination consists of a total of 8 different pages. The last two pages include a periodic table, a
CHEM 1515 Exam II John II. Gelder October 14, 1993 Name TA's Name Lab Section INSTRUCTIONS: 1. This examination consists of a total of 8 different pages. The last two pages include a periodic table, a
Last 4 Digits of USC ID:
 Chemistry 05 B Practice Exam Dr. Jessica Parr First Letter of last Name PLEASE PRINT YOUR NAME IN BLOCK LETTERS Name: Last 4 Digits of USC ID: Lab TA s Name: Question Points Score Grader 8 2 4 3 9 4 0
Chemistry 05 B Practice Exam Dr. Jessica Parr First Letter of last Name PLEASE PRINT YOUR NAME IN BLOCK LETTERS Name: Last 4 Digits of USC ID: Lab TA s Name: Question Points Score Grader 8 2 4 3 9 4 0
Physical Chemistry I CHEM 4641 Final Exam 13 questions, 30 points
 Physical Chemistry I CHEM 4641 Final Exam 13 questions, 30 points Name: KEY Gas constant: R = 8.314 J mol -1 K -1 = 0.008314 kj mol -1 K -1. Boltzmann constant k = 1.381 10-23 J/K = 0.6950 cm -1 /K h =
Physical Chemistry I CHEM 4641 Final Exam 13 questions, 30 points Name: KEY Gas constant: R = 8.314 J mol -1 K -1 = 0.008314 kj mol -1 K -1. Boltzmann constant k = 1.381 10-23 J/K = 0.6950 cm -1 /K h =
TERMINOLÓGIA A JEDNOTKY OPTICKÉHO ŽIARENIA
 TERMINOLÓGIA A JEDNOTKY OPTICKÉHO ŽIARENIA OEaLT Prednáška 2 Rádiometrické a fotometrické veličiny iny a jednotky Rádiometrická Fotometrická veličina symbol jednotka veličina sym -bol jednotka Energia
TERMINOLÓGIA A JEDNOTKY OPTICKÉHO ŽIARENIA OEaLT Prednáška 2 Rádiometrické a fotometrické veličiny iny a jednotky Rádiometrická Fotometrická veličina symbol jednotka veličina sym -bol jednotka Energia
A L A BA M A L A W R E V IE W
 A L A BA M A L A W R E V IE W Volume 52 Fall 2000 Number 1 B E F O R E D I S A B I L I T Y C I V I L R I G HT S : C I V I L W A R P E N S I O N S A N D TH E P O L I T I C S O F D I S A B I L I T Y I N
A L A BA M A L A W R E V IE W Volume 52 Fall 2000 Number 1 B E F O R E D I S A B I L I T Y C I V I L R I G HT S : C I V I L W A R P E N S I O N S A N D TH E P O L I T I C S O F D I S A B I L I T Y I N
(C) Pavel Sedach and Prep101 1
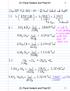 (C) Pavel Sedach and Prep101 1 (C) Pavel Sedach and Prep101 1 (C) Pavel Sedach and Prep101 2 (C) Pavel Sedach and Prep101 2 (C) Pavel Sedach and Prep101 3 (C) Pavel Sedach and Prep101 3 (C) Pavel Sedach
(C) Pavel Sedach and Prep101 1 (C) Pavel Sedach and Prep101 1 (C) Pavel Sedach and Prep101 2 (C) Pavel Sedach and Prep101 2 (C) Pavel Sedach and Prep101 3 (C) Pavel Sedach and Prep101 3 (C) Pavel Sedach
CHEM 108 (Spring-2008) Exam. 3 (105 pts)
 CHEM 08 (Spring-008) Exam. (05 pts) Name: --------------------------------------------------------------------------, CLID # -------------------------------- LAST NAME, First (Circle the alphabet segment
CHEM 08 (Spring-008) Exam. (05 pts) Name: --------------------------------------------------------------------------, CLID # -------------------------------- LAST NAME, First (Circle the alphabet segment
Chemistry 431 Practice Final Exam Fall Hours
 Chemistry 431 Practice Final Exam Fall 2018 3 Hours R =8.3144 J mol 1 K 1 R=.0821 L atm mol 1 K 1 R=.08314 L bar mol 1 K 1 k=1.381 10 23 J molecule 1 K 1 h=6.626 10 34 Js N A = 6.022 10 23 molecules mol
Chemistry 431 Practice Final Exam Fall 2018 3 Hours R =8.3144 J mol 1 K 1 R=.0821 L atm mol 1 K 1 R=.08314 L bar mol 1 K 1 k=1.381 10 23 J molecule 1 K 1 h=6.626 10 34 Js N A = 6.022 10 23 molecules mol
Kapitola S5. Skrutkovica na rotačnej ploche
 Kapitola S5 Skrutkovica na rotačnej ploche Nech je rotačná plocha určená osou rotácie o a meridiánom m. Skrutkový pohyb je pohyb zložený z rovnomerného rotačného pohybu okolo osi o a z rovnomerného translačného
Kapitola S5 Skrutkovica na rotačnej ploche Nech je rotačná plocha určená osou rotácie o a meridiánom m. Skrutkový pohyb je pohyb zložený z rovnomerného rotačného pohybu okolo osi o a z rovnomerného translačného
Chapter 3: Stoichiometry
 Chapter 3: Stoichiometry Chem 6A Michael J. Sailor, UC San Diego 1 Announcements: Thursday (Sep 29) quiz: Bring student ID or we cannot accept your quiz! No notes, no calculators Covers chapters 1 and
Chapter 3: Stoichiometry Chem 6A Michael J. Sailor, UC San Diego 1 Announcements: Thursday (Sep 29) quiz: Bring student ID or we cannot accept your quiz! No notes, no calculators Covers chapters 1 and
M10/4/CHEMI/SPM/ENG/TZ2/XX+ CHEMISTRY. Wednesday 12 May 2010 (afternoon) 45 minutes INSTRUCTIONS TO CANDIDATES
 M10/4/CHEMI/SPM/ENG/TZ/XX+ 106116 CHEMISTRY standard level Paper 1 Wednesday 1 May 010 (afternoon) 45 minutes INSTRUCTIONS TO CANDIDATES Do not open this examination paper until instructed to do so. Answer
M10/4/CHEMI/SPM/ENG/TZ/XX+ 106116 CHEMISTRY standard level Paper 1 Wednesday 1 May 010 (afternoon) 45 minutes INSTRUCTIONS TO CANDIDATES Do not open this examination paper until instructed to do so. Answer
02/05/09 Last 4 Digits of USC ID: Dr. Jessica Parr
 Chemistry 05 B First Letter of PLEASE PRINT YOUR NAME IN BLOCK LETTERS Exam last Name Name: 02/05/09 Last 4 Digits of USC ID: Dr. Jessica Parr Lab TA s Name: Question Points Score Grader 2 2 9 3 9 4 2
Chemistry 05 B First Letter of PLEASE PRINT YOUR NAME IN BLOCK LETTERS Exam last Name Name: 02/05/09 Last 4 Digits of USC ID: Dr. Jessica Parr Lab TA s Name: Question Points Score Grader 2 2 9 3 9 4 2
M14/4/CHEMI/SPM/ENG/TZ1/XX CHEMISTRY. Monday 19 May 2014 (afternoon) 45 minutes INSTRUCTIONS TO CANDIDATES
 M14/4/CEMI/SPM/ENG/TZ1/XX 22146110 CEMISTRY standard level Paper 1 Monday 19 May 2014 (afternoon) 45 minutes INSTRUCTIONS TO CANDIDATES Do not open this examination paper until instructed to do so. Answer
M14/4/CEMI/SPM/ENG/TZ1/XX 22146110 CEMISTRY standard level Paper 1 Monday 19 May 2014 (afternoon) 45 minutes INSTRUCTIONS TO CANDIDATES Do not open this examination paper until instructed to do so. Answer
PLEASE PRINT YOUR NAME IN BLOCK LETTERS. Practice Exam 3. Last 4 Digits of USC ID:
 Chemistry 105 B Practice Exam 3 Dr. Jessica Parr First Letter of last Name PLEASE PRINT YOUR NAME IN BLOCK LETTERS Name: Last 4 Digits of USC ID: Lab TA s Name: Question Points Score Grader 1 18 2 14 3
Chemistry 105 B Practice Exam 3 Dr. Jessica Parr First Letter of last Name PLEASE PRINT YOUR NAME IN BLOCK LETTERS Name: Last 4 Digits of USC ID: Lab TA s Name: Question Points Score Grader 1 18 2 14 3
Circle the letters only. NO ANSWERS in the Columns! (3 points each)
 Chemistry 1304.001 Name (please print) Exam 4 (100 points) April 12, 2017 On my honor, I have neither given nor received unauthorized aid on this exam. Signed Date Circle the letters only. NO ANSWERS in
Chemistry 1304.001 Name (please print) Exam 4 (100 points) April 12, 2017 On my honor, I have neither given nor received unauthorized aid on this exam. Signed Date Circle the letters only. NO ANSWERS in
M11/4/CHEMI/SPM/ENG/TZ2/XX CHEMISTRY STANDARD LEVEL PAPER 1. Monday 9 May 2011 (afternoon) 45 minutes INSTRUCTIONS TO CANDIDATES
 M11/4/CHEMI/SPM/ENG/TZ/XX 116116 CHEMISTRY STANDARD LEVEL PAPER 1 Monday 9 May 011 (afternoon) 45 minutes INSTRUCTIONS TO CANDIDATES Do not open this examination paper until instructed to do so. Answer
M11/4/CHEMI/SPM/ENG/TZ/XX 116116 CHEMISTRY STANDARD LEVEL PAPER 1 Monday 9 May 011 (afternoon) 45 minutes INSTRUCTIONS TO CANDIDATES Do not open this examination paper until instructed to do so. Answer
Chemistry Standard level Paper 1
 M15/4/CHEMI/SPM/ENG/TZ1/XX Chemistry Standard level Paper 1 Thursday 14 May 2015 (afternoon) 45 minutes Instructions to candidates Do not open this examination paper until instructed to do so. Answer all
M15/4/CHEMI/SPM/ENG/TZ1/XX Chemistry Standard level Paper 1 Thursday 14 May 2015 (afternoon) 45 minutes Instructions to candidates Do not open this examination paper until instructed to do so. Answer all
Chemistry 185 Exam #2 - A November 5, Lab Day and Time: Instructions. 1. Do not open the exam until you are told to start.
 Name: Lab Day and Time: Instructions 1. Do not open the exam until you are told to start. 2. This exam is closed note and closed book. You are not allowed to use any outside material while taking this
Name: Lab Day and Time: Instructions 1. Do not open the exam until you are told to start. 2. This exam is closed note and closed book. You are not allowed to use any outside material while taking this
HANDOUT SET GENERAL CHEMISTRY II
 HANDOUT SET GENERAL CHEMISTRY II Periodic Table of the Elements 1 2 3 4 5 6 7 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 IA VIIIA 1 2 H He 1.00794 IIA IIIA IVA VA VIA VIIA 4.00262 3 Li 6.941 11 Na 22.9898
HANDOUT SET GENERAL CHEMISTRY II Periodic Table of the Elements 1 2 3 4 5 6 7 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 IA VIIIA 1 2 H He 1.00794 IIA IIIA IVA VA VIA VIIA 4.00262 3 Li 6.941 11 Na 22.9898
Lab Day and Time: Instructions. 1. Do not open the exam until you are told to start.
 Name: Lab Day and Time: Instructions 1. Do not open the exam until you are told to start. 2. This exam is closed note and closed book. You are not allowed to use any outside material while taking this
Name: Lab Day and Time: Instructions 1. Do not open the exam until you are told to start. 2. This exam is closed note and closed book. You are not allowed to use any outside material while taking this
8. ELECTROCHEMICAL CELLS. n Electrode Reactions and Electrode Potentials a. H 2 2H + + 2e. Cl 2 + 2e 2Cl. H 2 + Cl 2 2H + + 2Cl ; z = 2
 8. ELECTROCHEMICAL CELLS n Electrode Reactions and Electrode Potentials 8.1. a. H H + + e Cl + e Cl H + Cl H + + Cl ; z = E = E RT F ln ( a H +a Cl ) b. Hg(l)+ Cl Hg Cl + e H + + e H Hg + H + + Cl Hg Cl
8. ELECTROCHEMICAL CELLS n Electrode Reactions and Electrode Potentials 8.1. a. H H + + e Cl + e Cl H + Cl H + + Cl ; z = E = E RT F ln ( a H +a Cl ) b. Hg(l)+ Cl Hg Cl + e H + + e H Hg + H + + Cl Hg Cl
Chemistry 2 Exam Roane State Academic Festival. Name (print neatly) School
 Name (print neatly) School There are fifteen question on this exam. Each question is weighted equally. n the answer sheet, write your name in the space provided and your answers in the blanks provided.
Name (print neatly) School There are fifteen question on this exam. Each question is weighted equally. n the answer sheet, write your name in the space provided and your answers in the blanks provided.
Circle the letters only. NO ANSWERS in the Columns!
 Chemistry 1304.001 Name (please print) Exam 5 (100 points) April 18, 2018 On my honor, I have neither given nor received unauthorized aid on this exam. Signed Date Circle the letters only. NO ANSWERS in
Chemistry 1304.001 Name (please print) Exam 5 (100 points) April 18, 2018 On my honor, I have neither given nor received unauthorized aid on this exam. Signed Date Circle the letters only. NO ANSWERS in
Fall 2011 CHEM Test 4, Form A
 Fall 2011 CHEM 1110.40413 Test 4, Form A Part I. Multiple Choice: Clearly circle the best answer. (60 pts) Name: 1. The common constituent in all acid solutions is A) H 2 SO 4 B) H 2 C) H + D) OH 2. Which
Fall 2011 CHEM 1110.40413 Test 4, Form A Part I. Multiple Choice: Clearly circle the best answer. (60 pts) Name: 1. The common constituent in all acid solutions is A) H 2 SO 4 B) H 2 C) H + D) OH 2. Which
Speed of light c = m/s. x n e a x d x = 1. 2 n+1 a n π a. He Li Ne Na Ar K Ni 58.
 Physical Chemistry II Test Name: KEY CHEM 464 Spring 18 Chapters 7-11 Average = 1. / 16 6 questions worth a total of 16 points Planck's constant h = 6.63 1-34 J s Speed of light c = 3. 1 8 m/s ħ = h π
Physical Chemistry II Test Name: KEY CHEM 464 Spring 18 Chapters 7-11 Average = 1. / 16 6 questions worth a total of 16 points Planck's constant h = 6.63 1-34 J s Speed of light c = 3. 1 8 m/s ħ = h π
30 Zn(s) 45 Rh. Pd(s) Ag(s) Cd(s) In(s) Sn(s) white. 77 Ir. Pt(s) Au. Hg(l) Tl. 109 Mt. 111 Uuu. 112 Uub. 110 Uun. 65 Tb. 62 Sm. 64 Gd. 63 Eu.
 Enthalpy changes: experimentally it is much easier to measure heat flow at const pressure - this is enthalpy q p = )H : also nearly all chemical reactions are done at constant pressure. Enthalpy (heat)
Enthalpy changes: experimentally it is much easier to measure heat flow at const pressure - this is enthalpy q p = )H : also nearly all chemical reactions are done at constant pressure. Enthalpy (heat)
INSTRUCTIONS: Exam III. November 10, 1999 Lab Section
 CHEM 1215 Exam III John III. Gelder November 10, 1999 Name TA's Name Lab Section INSTRUCTIONS: 1. This examination consists of a total of 7 different pages. The last page includes a periodic table and
CHEM 1215 Exam III John III. Gelder November 10, 1999 Name TA's Name Lab Section INSTRUCTIONS: 1. This examination consists of a total of 7 different pages. The last page includes a periodic table and
Chemistry Standard level Paper 1
 Chemistry Standard level Paper 1 Thursday 12 May 2016 (morning) 45 minutes Instructions to candidates Do not open this examination paper until instructed to do so. Answer all the questions. For each question,
Chemistry Standard level Paper 1 Thursday 12 May 2016 (morning) 45 minutes Instructions to candidates Do not open this examination paper until instructed to do so. Answer all the questions. For each question,
CHEM 108 (Spring-2008)
 CHEM 108 (Spring-2008) Final Exam (106 pts) Name: --------------------------------------------------------------------------, CLID # -------------------------------- LAST NAME, First (Circle the alphabet
CHEM 108 (Spring-2008) Final Exam (106 pts) Name: --------------------------------------------------------------------------, CLID # -------------------------------- LAST NAME, First (Circle the alphabet
Chemistry 2000 Fall 2017 Final Examination
 Time: 3 hours hemistry 2000 Fall 2017 Final Examination Total marks: 105 Aids permitted: calculator (wireless communication capabilities OFF), molecular model kit. Significant figures: I will specifically
Time: 3 hours hemistry 2000 Fall 2017 Final Examination Total marks: 105 Aids permitted: calculator (wireless communication capabilities OFF), molecular model kit. Significant figures: I will specifically
M09/4/CHEMI/SPM/ENG/TZ1/XX+ CHEMISTRY. Monday 18 May 2009 (afternoon) 45 minutes INSTRUCTIONS TO CANDIDATES
 M09/4/CHEMI/SPM/ENG/TZ1/XX+ 22096110 CHEMISTRY standard level Paper 1 Monday 18 May 2009 (afternoon) 45 minutes INSTRUCTIONS TO CANDIDATES Do not open this examination paper until instructed to do so.
M09/4/CHEMI/SPM/ENG/TZ1/XX+ 22096110 CHEMISTRY standard level Paper 1 Monday 18 May 2009 (afternoon) 45 minutes INSTRUCTIONS TO CANDIDATES Do not open this examination paper until instructed to do so.
Chem 102H Exam 2 - Spring 2005
 Name I.D. # Chem 102H Exam 2 - Spring 2005 PHYSICAL CNSTANTS/CNVERSIN FACTRS Speed of light = 3.00! 10 8 m/s Planck!s const. = 6.63! 10-34 J s Avagadro!s Number = 6.02! 10 23 Electron charge = 1.602! 10-19
Name I.D. # Chem 102H Exam 2 - Spring 2005 PHYSICAL CNSTANTS/CNVERSIN FACTRS Speed of light = 3.00! 10 8 m/s Planck!s const. = 6.63! 10-34 J s Avagadro!s Number = 6.02! 10 23 Electron charge = 1.602! 10-19
Lab Day and Time: Instructions. 1. Do not open the exam until you are told to start.
 Name: Lab Day and Time: Instructions 1. Do not open the exam until you are told to start. 2. This exam is closed note and closed book. You are not allowed to use any outside material while taking this
Name: Lab Day and Time: Instructions 1. Do not open the exam until you are told to start. 2. This exam is closed note and closed book. You are not allowed to use any outside material while taking this
8. Relax and do well.
 CHEM 1215 Exam III John III. Gelder November 11, 1998 Name TA's Name Lab Section INSTRUCTIONS: 1. This examination consists of a total of 7 different pages. The last page includes a periodic table and
CHEM 1215 Exam III John III. Gelder November 11, 1998 Name TA's Name Lab Section INSTRUCTIONS: 1. This examination consists of a total of 7 different pages. The last page includes a periodic table and
Faculty of Natural and Agricultural Sciences Chemistry Department. Semester Test 1 MEMO. Analytical Chemistry CMY 283
 Faculty of Natural and Agricultural Sciences Chemistry Department Semester Test 1 MEMO Analytical Chemistry CMY 283 Date: 5 September 2016 Lecturers : Prof P Forbes, Dr Laurens, Mr SA Nsibande Time: 90
Faculty of Natural and Agricultural Sciences Chemistry Department Semester Test 1 MEMO Analytical Chemistry CMY 283 Date: 5 September 2016 Lecturers : Prof P Forbes, Dr Laurens, Mr SA Nsibande Time: 90
[ ]:543.4(075.8) 35.20: ,..,..,.., : /... ;. 2-. ISBN , - [ ]:543.4(075.8) 35.20:34.
![[ ]:543.4(075.8) 35.20: ,..,..,.., : /... ;. 2-. ISBN , - [ ]:543.4(075.8) 35.20:34. [ ]:543.4(075.8) 35.20: ,..,..,.., : /... ;. 2-. ISBN , - [ ]:543.4(075.8) 35.20:34.](/thumbs/74/69911105.jpg) .. - 2-2009 [661.87.+661.88]:543.4(075.8) 35.20:34.2373-60..,..,..,..,.. -60 : /... ;. 2-. : -, 2008. 134. ISBN 5-98298-299-7 -., -,,. - «,, -, -», - 550800,, 240600 «-», -. [661.87.+661.88]:543.4(075.8)
.. - 2-2009 [661.87.+661.88]:543.4(075.8) 35.20:34.2373-60..,..,..,..,.. -60 : /... ;. 2-. : -, 2008. 134. ISBN 5-98298-299-7 -., -,,. - «,, -, -», - 550800,, 240600 «-», -. [661.87.+661.88]:543.4(075.8)
Chem Exam 1. September 26, Dr. Susan E. Bates. Name 9:00 OR 10:00
 Chem 1711 Exam 1 September 26, 2013 Dr. Susan E. Bates Name 9:00 OR 10:00 N A = 6.022 x 10 23 mol 1 I A II A III B IV B V B VI B VII B VIII I B II B III A IV A V A VI A VII A inert gases 1 H 1.008 3 Li
Chem 1711 Exam 1 September 26, 2013 Dr. Susan E. Bates Name 9:00 OR 10:00 N A = 6.022 x 10 23 mol 1 I A II A III B IV B V B VI B VII B VIII I B II B III A IV A V A VI A VII A inert gases 1 H 1.008 3 Li
Teória grafov. RNDr. Milan Stacho, PhD.
 Teória grafov RNDr. Milan Stacho, PhD. Literatúra Plesník: Grafové algoritmy, Veda Bratislava 1983 Sedláček: Úvod do teórie grafů, Academia Praha 1981 Bosák: Grafy a ich aplikácie, Alfa Bratislava 1980
Teória grafov RNDr. Milan Stacho, PhD. Literatúra Plesník: Grafové algoritmy, Veda Bratislava 1983 Sedláček: Úvod do teórie grafů, Academia Praha 1981 Bosák: Grafy a ich aplikácie, Alfa Bratislava 1980
P a g e 5 1 of R e p o r t P B 4 / 0 9
 P a g e 5 1 of R e p o r t P B 4 / 0 9 J A R T a l s o c o n c l u d e d t h a t a l t h o u g h t h e i n t e n t o f N e l s o n s r e h a b i l i t a t i o n p l a n i s t o e n h a n c e c o n n e
P a g e 5 1 of R e p o r t P B 4 / 0 9 J A R T a l s o c o n c l u d e d t h a t a l t h o u g h t h e i n t e n t o f N e l s o n s r e h a b i l i t a t i o n p l a n i s t o e n h a n c e c o n n e
BROOKLYN COLLEGE Department of Chemistry. Chemistry 1 Second Lecture Exam Nov. 27, Name Page 1 of 5
 BROOKLYN COLLEGE Department of Chemistry Chemistry 1 Second Lecture Exam Nov. 27, 2002 Name Page 1 of 5 Circle the name of your lab instructor Kobrak, Zhou, Girotto, Hussey, Du Before you begin the exam,
BROOKLYN COLLEGE Department of Chemistry Chemistry 1 Second Lecture Exam Nov. 27, 2002 Name Page 1 of 5 Circle the name of your lab instructor Kobrak, Zhou, Girotto, Hussey, Du Before you begin the exam,
Faculty of Natural and Agricultural Sciences Chemistry Department. Semester Test 1. Analytical Chemistry CMY 283. Time: 120 min Marks: 100 Pages: 6
 Faculty of Natural and Agricultural Sciences Chemistry Department Semester Test 1 Analytical Chemistry CMY 283 Date: 5 September 2016 Lecturers : Prof P Forbes, Dr Laurens, Mr SA Nsibande Time: 120 min
Faculty of Natural and Agricultural Sciences Chemistry Department Semester Test 1 Analytical Chemistry CMY 283 Date: 5 September 2016 Lecturers : Prof P Forbes, Dr Laurens, Mr SA Nsibande Time: 120 min
8. Relax and do well.
 CHEM 1225 Exam I John I. Gelder February 4, 1999 Name KEY TA's Name Lab Section Please sign your name below to give permission to post your course scores on homework, laboratories and exams. If you do
CHEM 1225 Exam I John I. Gelder February 4, 1999 Name KEY TA's Name Lab Section Please sign your name below to give permission to post your course scores on homework, laboratories and exams. If you do
8. Relax and do well.
 CHEM 15 Exam II John II. Gelder March 4, 1999 Name TA's Name Lab Section INSTRUCTIONS: 1. This examination consists of a total of 7 different pages. The last two pages includes a periodic table, a solubility
CHEM 15 Exam II John II. Gelder March 4, 1999 Name TA's Name Lab Section INSTRUCTIONS: 1. This examination consists of a total of 7 different pages. The last two pages includes a periodic table, a solubility
8. Relax and do well.
 CHEM 34.02 and 34.03 Name Exam III John III. Gelder TA's Name November 5, 2000 Lab Section INSTRUCTIONS:. This examination consists of a total of 9 different pages. The last three pages include a periodic
CHEM 34.02 and 34.03 Name Exam III John III. Gelder TA's Name November 5, 2000 Lab Section INSTRUCTIONS:. This examination consists of a total of 9 different pages. The last three pages include a periodic
Guide to the Extended Step-Pyramid Periodic Table
 Guide to the Extended Step-Pyramid Periodic Table William B. Jensen Department of Chemistry University of Cincinnati Cincinnati, OH 452201-0172 The extended step-pyramid table recognizes that elements
Guide to the Extended Step-Pyramid Periodic Table William B. Jensen Department of Chemistry University of Cincinnati Cincinnati, OH 452201-0172 The extended step-pyramid table recognizes that elements
CHEM 167 FINAL EXAM MONDAY, MAY 2 9:45 11:45 A.M GILMAN HALL
 PROF. JOHN VERKADE SPRING 2005 THIS EXAM CONSISTS OF 12 QUESTIONS ON 9 PAGES CHEM 167 HOUR EXAM IV APRIL 20, 2005 SEAT NO. NAME RECIT. INSTR. RECIT. SECT. GRADING PAGE Page 2 Page 3 Page 4 Page 5 Page
PROF. JOHN VERKADE SPRING 2005 THIS EXAM CONSISTS OF 12 QUESTIONS ON 9 PAGES CHEM 167 HOUR EXAM IV APRIL 20, 2005 SEAT NO. NAME RECIT. INSTR. RECIT. SECT. GRADING PAGE Page 2 Page 3 Page 4 Page 5 Page
Ing. Tomasz Kanik. doc. RNDr. Štefan Peško, CSc.
 Ing. Tomasz Kanik Školiteľ: doc. RNDr. Štefan Peško, CSc. Pracovisko: Študijný program: KMMOA, FRI, ŽU 9.2.9 Aplikovaná informatika 1 identifikácia problémovej skupiny pacientov, zlepšenie kvality rozhodovacích
Ing. Tomasz Kanik Školiteľ: doc. RNDr. Štefan Peško, CSc. Pracovisko: Študijný program: KMMOA, FRI, ŽU 9.2.9 Aplikovaná informatika 1 identifikácia problémovej skupiny pacientov, zlepšenie kvality rozhodovacích
CHEM 10123/10125, Exam 2
 CHEM 10123/10125, Exam 2 March 7, 2012 (50 minutes) Name (please print) Please box your answers, and remember that significant figures, phases (for chemical equations), and units do count! 1. (13 points)
CHEM 10123/10125, Exam 2 March 7, 2012 (50 minutes) Name (please print) Please box your answers, and remember that significant figures, phases (for chemical equations), and units do count! 1. (13 points)
EMA4303/5305 Electrochemical Engineering Lecture 02 Equilibrium Electrochemistry
 EMA4303/5305 Electrochemical Engineering Lecture 02 Equilibrium Electrochemistry Dr. Junheng Xing, Prof. Zhe Cheng Mechanical & Materials Engineering Florida International University 2 Equilibrium Electrochemistry
EMA4303/5305 Electrochemical Engineering Lecture 02 Equilibrium Electrochemistry Dr. Junheng Xing, Prof. Zhe Cheng Mechanical & Materials Engineering Florida International University 2 Equilibrium Electrochemistry
Computer Applications in Hydraulic Engineering
 Computer Applications in Hydraulic Engineering www.haestad.com Academic CD Aplikácie výpočtovej techniky v hydraulike pre inžinierov Flow Master General Flow Characteristic Všeobecná charakteristika prúdenia
Computer Applications in Hydraulic Engineering www.haestad.com Academic CD Aplikácie výpočtovej techniky v hydraulike pre inžinierov Flow Master General Flow Characteristic Všeobecná charakteristika prúdenia
PERIODIC TABLE OF THE ELEMENTS
 Useful Constants and equations: K = o C + 273 Avogadro's number = 6.022 x 10 23 d = density = mass/volume R H = 2.178 x 10-18 J c = E = h = hc/ h = 6.626 x 10-34 J s c = 2.998 x 10 8 m/s E n = -R H Z 2
Useful Constants and equations: K = o C + 273 Avogadro's number = 6.022 x 10 23 d = density = mass/volume R H = 2.178 x 10-18 J c = E = h = hc/ h = 6.626 x 10-34 J s c = 2.998 x 10 8 m/s E n = -R H Z 2
Our country, our future 525/1 S6 CHEMISTRY PAPER 1 DURATION: 2 HOUR 45 MINUTES
 1 Our country, our future 525/1 S6 CHEMISTRY Exam 10 PAPER 1 DURATION: 2 HOUR 45 MINUTES For Marking guide contact and consultations: Dr. Bbosa Science 0776 802709, Instructions - This paper consists of
1 Our country, our future 525/1 S6 CHEMISTRY Exam 10 PAPER 1 DURATION: 2 HOUR 45 MINUTES For Marking guide contact and consultations: Dr. Bbosa Science 0776 802709, Instructions - This paper consists of
CHEM 4641 Fall questions worth a total of 32 points. Show your work, except on multiple-choice questions. 1 V α=
 Physical Chemistry I Final Exam Name: KEY CHEM 4641 Fall 017 15 questions worth a total of 3 points. Show your work, except on multiple-choice questions. 1 V 1 V α= κt = V T P V P T Gas constant R = 8.314
Physical Chemistry I Final Exam Name: KEY CHEM 4641 Fall 017 15 questions worth a total of 3 points. Show your work, except on multiple-choice questions. 1 V 1 V α= κt = V T P V P T Gas constant R = 8.314
Solutions and Ions. Pure Substances
 Class #4 Solutions and Ions CHEM 107 L.S. Brown Texas A&M University Pure Substances Pure substance: described completely by a single chemical formula Fixed composition 1 Mixtures Combination of 2 or more
Class #4 Solutions and Ions CHEM 107 L.S. Brown Texas A&M University Pure Substances Pure substance: described completely by a single chemical formula Fixed composition 1 Mixtures Combination of 2 or more
Part 2. Multiple choice (use answer card). 90 pts. total. 3 pts. each.
 1 Exam I CHEM 1303.001 Name (print legibly) Seat no. On my honor, I have neither given nor received unauthorized aid on this exam. Signed Date Part 1. Nomenclature. 10 pts. total. 2 pts. each. Fill in
1 Exam I CHEM 1303.001 Name (print legibly) Seat no. On my honor, I have neither given nor received unauthorized aid on this exam. Signed Date Part 1. Nomenclature. 10 pts. total. 2 pts. each. Fill in
If anything confuses you or is not clear, raise your hand and ask!
 CHM 1045 Dr. Light s Section December 10, 2002 FINAL EXAM Name (please print) Recitation Section Meeting Time This exam consists of six pages. Make sure you have one of each. Print your name at the top
CHM 1045 Dr. Light s Section December 10, 2002 FINAL EXAM Name (please print) Recitation Section Meeting Time This exam consists of six pages. Make sure you have one of each. Print your name at the top
Marks for each question are as indicated in [] brackets.
![Marks for each question are as indicated in [] brackets. Marks for each question are as indicated in [] brackets.](/thumbs/77/75878580.jpg) Name Student Number CHEMISTRY 140 FINAL EXAM December 10, 2002 Numerical answers must be given with appropriate units and significant figures. Please place all answers in the space provided for the question.
Name Student Number CHEMISTRY 140 FINAL EXAM December 10, 2002 Numerical answers must be given with appropriate units and significant figures. Please place all answers in the space provided for the question.
POLYTECHNIC OF NAMIBIA
 POLYTECHNIC OF NAMIBIA DEPARTMENT OF HEALTH SCIENCES BACHELOR OF ENVIRONMENTAL HEALTH SCIENCES HEALTH SCIENCE CHEMISTRY (HSC 511S) NQF level 5 SECOND OPPORTUNITY EXAMINATION November 2014 TIME: MARKS:
POLYTECHNIC OF NAMIBIA DEPARTMENT OF HEALTH SCIENCES BACHELOR OF ENVIRONMENTAL HEALTH SCIENCES HEALTH SCIENCE CHEMISTRY (HSC 511S) NQF level 5 SECOND OPPORTUNITY EXAMINATION November 2014 TIME: MARKS:
VOLFRÁMOVÝ ATOMIZÁTOR - ŠTÚDIUM ATOMIZAČNÝCH REAKCIÍ NIEKTORÝCH PRCHAVÝCH ANALYTOV
 VOLFRÁMOVÝ ATOMIZÁTOR - ŠTÚDIUM ATOMIZAČNÝCH REAKCIÍ NIEKTORÝCH PRCHAVÝCH ANALYTOV Krakovská K. 1, Remeteiová D. 2 1 Katedra chémie, Hutnícka fakulta, Technická univerzita Košice 2 Katedra mineralurgie
VOLFRÁMOVÝ ATOMIZÁTOR - ŠTÚDIUM ATOMIZAČNÝCH REAKCIÍ NIEKTORÝCH PRCHAVÝCH ANALYTOV Krakovská K. 1, Remeteiová D. 2 1 Katedra chémie, Hutnícka fakulta, Technická univerzita Košice 2 Katedra mineralurgie
CLASS TEST GRADE 11. PHYSICAL SCIENCES: CHEMISTRY Test 4: Matter and materials 1
 CLASS TEST GRADE PHYSICAL SCIENCES: CHEMISTRY Test 4: Matter and materials MARKS: 45 TIME: hour INSTRUCTIONS AND INFORMATION. Answer ALL the questions. 2. You may use non-programmable calculators. 3. You
CLASS TEST GRADE PHYSICAL SCIENCES: CHEMISTRY Test 4: Matter and materials MARKS: 45 TIME: hour INSTRUCTIONS AND INFORMATION. Answer ALL the questions. 2. You may use non-programmable calculators. 3. You
DURATION: 2 HOUR 45 MINUTES
 1 Exam 9 Our country, our future 525/1 S6 CHEMISTRY PAPER 1 DURATION: 2 HOUR 45 MINUTES For Marking guide contact and consultations: Dr. Bbosa Science 0776 802709. Answer all question in part I and six
1 Exam 9 Our country, our future 525/1 S6 CHEMISTRY PAPER 1 DURATION: 2 HOUR 45 MINUTES For Marking guide contact and consultations: Dr. Bbosa Science 0776 802709. Answer all question in part I and six
Formulas and Constants (you may remove this page)
 Formulas and Constants (you may remove this page) NA = 6.0x0 3 mol - h = 6.66x0-34 J s c =.99x0 m s - e =.60x0-9 C me = 9.09x0-3 kg Å = x0-0 m = 00 pm atm = 760 torr R = 0.006 L atm K - mol - =.34 J K
Formulas and Constants (you may remove this page) NA = 6.0x0 3 mol - h = 6.66x0-34 J s c =.99x0 m s - e =.60x0-9 C me = 9.09x0-3 kg Å = x0-0 m = 00 pm atm = 760 torr R = 0.006 L atm K - mol - =.34 J K
8. Relax and do well.
 CHEM 1225 Exam III John III. Gelder April 8, 1999 Name TA's Name Lab Section INSTRUCTIONS: 1. This examination consists of a total of 7 different pages. The last two pages includes a periodic table and
CHEM 1225 Exam III John III. Gelder April 8, 1999 Name TA's Name Lab Section INSTRUCTIONS: 1. This examination consists of a total of 7 different pages. The last two pages includes a periodic table and
PART 1 Introduction to Theory of Solids
 Elsevier UK Job code: MIOC Ch01-I044647 9-3-2007 3:03p.m. Page:1 Trim:165 240MM TS: Integra, India PART 1 Introduction to Theory of Solids Elsevier UK Job code: MIOC Ch01-I044647 9-3-2007 3:03p.m. Page:2
Elsevier UK Job code: MIOC Ch01-I044647 9-3-2007 3:03p.m. Page:1 Trim:165 240MM TS: Integra, India PART 1 Introduction to Theory of Solids Elsevier UK Job code: MIOC Ch01-I044647 9-3-2007 3:03p.m. Page:2
5 questions, 3 points each, 15 points total possible. 26 Fe Cu Ni Co Pd Ag Ru 101.
 Physical Chemistry II Lab CHEM 4644 spring 2017 final exam KEY 5 questions, 3 points each, 15 points total possible h = 6.626 10-34 J s c = 3.00 10 8 m/s 1 GHz = 10 9 s -1. B= h 8π 2 I ν= 1 2 π k μ 6 P
Physical Chemistry II Lab CHEM 4644 spring 2017 final exam KEY 5 questions, 3 points each, 15 points total possible h = 6.626 10-34 J s c = 3.00 10 8 m/s 1 GHz = 10 9 s -1. B= h 8π 2 I ν= 1 2 π k μ 6 P
7. Relax and do well.
 CHEM 1215 Exam II John II. Gelder October 7, 1998 Name TA's Name Lab Section INSTRUCTIONS: 1. This examination consists of a total of 5 different pages. The last page includes a periodic table and a solubility
CHEM 1215 Exam II John II. Gelder October 7, 1998 Name TA's Name Lab Section INSTRUCTIONS: 1. This examination consists of a total of 5 different pages. The last page includes a periodic table and a solubility
7. Relax and do well.
 CHEM 1215 Exam II John II. Gelder October 7, 1998 Name TA's Name Lab Section INSTRUCTIONS: 1. This examination consists of a total of 5 different pages. The last page includes a periodic table and a solubility
CHEM 1215 Exam II John II. Gelder October 7, 1998 Name TA's Name Lab Section INSTRUCTIONS: 1. This examination consists of a total of 5 different pages. The last page includes a periodic table and a solubility
Lab Day and Time: Instructions. 1. Do not open the exam until you are told to start.
 Name: Lab Day and Time: Instructions 1. Do not open the exam until you are told to start. 2. This exam is closed note and closed book. You are not allowed to use any outside material while taking this
Name: Lab Day and Time: Instructions 1. Do not open the exam until you are told to start. 2. This exam is closed note and closed book. You are not allowed to use any outside material while taking this
Initial amounts: mol Amounts at equilibrium: mol (5) Initial amounts: x mol Amounts at equilibrium: x mol
 4. CHEMICAL EQUILIBRIUM n Equilibrium Constants 4.1. 2A Y + 2Z Initial amounts: 4 0 0 mol Amounts at equilibrium: 1 1.5 3.0 mol Concentrations at equilibrium: 1 5 1.5 5 3.0 5 mol dm 3 K c (1.5/5) (3.0/5)2
4. CHEMICAL EQUILIBRIUM n Equilibrium Constants 4.1. 2A Y + 2Z Initial amounts: 4 0 0 mol Amounts at equilibrium: 1 1.5 3.0 mol Concentrations at equilibrium: 1 5 1.5 5 3.0 5 mol dm 3 K c (1.5/5) (3.0/5)2
The Periodic Table. Periodic Properties. Can you explain this graph? Valence Electrons. Valence Electrons. Paramagnetism
 Periodic Properties Atomic & Ionic Radius Energy Electron Affinity We want to understand the variations in these properties in terms of electron configurations. The Periodic Table Elements in a column
Periodic Properties Atomic & Ionic Radius Energy Electron Affinity We want to understand the variations in these properties in terms of electron configurations. The Periodic Table Elements in a column
7. Relax and do well.
 CHEM 1215 Exam II John II. Gelder October 13, 1999 Name TA's Name Lab Section INSTRUCTIONS: 1. This examination consists of a total of 5 different pages. The last page includes a periodic table and a solubility
CHEM 1215 Exam II John II. Gelder October 13, 1999 Name TA's Name Lab Section INSTRUCTIONS: 1. This examination consists of a total of 5 different pages. The last page includes a periodic table and a solubility
610B Final Exam Cover Page
 1 st Letter of Last Name NAME: 610B Final Exam Cover Page No notes or calculators of any sort allowed. You have 3 hours to complete the exam. CHEM 610B, 50995 Final Exam Fall 2003 Instructor: Dr. Brian
1 st Letter of Last Name NAME: 610B Final Exam Cover Page No notes or calculators of any sort allowed. You have 3 hours to complete the exam. CHEM 610B, 50995 Final Exam Fall 2003 Instructor: Dr. Brian
Secondary Support Pack. be introduced to some of the different elements within the periodic table;
 Secondary Support Pack INTRODUCTION The periodic table of the elements is central to chemistry as we know it today and the study of it is a key part of every student s chemical education. By playing the
Secondary Support Pack INTRODUCTION The periodic table of the elements is central to chemistry as we know it today and the study of it is a key part of every student s chemical education. By playing the
Course theme. Three hours of lab Complete E1 (Parts 1, 2, 3, 4, and 5B) Prepare discussion presentation Prepare team report.
 Experiment Session 2 Electrons and Solution Color Three hours of lab Complete E (Parts, 2, 3, 4, and 5B) Prepare discussion presentation Prepare team report. Course theme There are structure and property
Experiment Session 2 Electrons and Solution Color Three hours of lab Complete E (Parts, 2, 3, 4, and 5B) Prepare discussion presentation Prepare team report. Course theme There are structure and property
Three hours of lab Complete E1 (Parts 1, 2, 3, 4, and 5B) Prepare discussion presentation Prepare team report. Course theme
 Experiment 1 Session 2 Electrons and Solution Color Three hours of lab Complete E1 (Parts 1, 2, 3, 4, and 5B) Prepare discussion presentation Prepare team report. Course theme There are structure and property
Experiment 1 Session 2 Electrons and Solution Color Three hours of lab Complete E1 (Parts 1, 2, 3, 4, and 5B) Prepare discussion presentation Prepare team report. Course theme There are structure and property
Premena solárnej energie na elektrickú prostredníctvom vzdialeného experimentu Transformation of Solar Energy to Electrical by Remote Experiment
 Premena solárnej energie na elektrickú prostredníctvom vzdialeného experimentu Transformation of Solar Energy to Electrical by Remote Experiment Žaneta Gerhátová 1 Lukáš Tkáč 2 1 Katedra fyziky, Pedagogická
Premena solárnej energie na elektrickú prostredníctvom vzdialeného experimentu Transformation of Solar Energy to Electrical by Remote Experiment Žaneta Gerhátová 1 Lukáš Tkáč 2 1 Katedra fyziky, Pedagogická
fotón gluón WaZ A.Einstein A.Compton Richter, Ting M.Gell-Mann Ledermann Schwartz Steinberger Friedman Kendall Taylor Gross,Wilczek,Politzer
 Program pre učiteľov fyziky z členských štátov CERNu Fyzika elementárnych častíc 1. z čoho sa skladá svet Martin Mojžiš elementárne častice elementárne fermióny leptóny kvarky elementárne bozóny fotón
Program pre učiteľov fyziky z členských štátov CERNu Fyzika elementárnych častíc 1. z čoho sa skladá svet Martin Mojžiš elementárne častice elementárne fermióny leptóny kvarky elementárne bozóny fotón
VYBRANÉ TERMOCHEMICKÉ VÝPOČTY CHEMICKEJ REAKCIE FORMOU WEBOVEJ SLUŽBY
 Chem. Listy 110, 874884(2016) VYBRANÉ TERMOCHEMICKÉ VÝPOČTY CHEMICKEJ REAKCIE FORMOU WEBOVEJ SLUŽBY PAVEL HOROVČÁK, JÁN TERPÁK a MATEJ LUKÁČ Technická univerzita, Letná 9, 042 00 Košice, Fakulta baníctva,
Chem. Listy 110, 874884(2016) VYBRANÉ TERMOCHEMICKÉ VÝPOČTY CHEMICKEJ REAKCIE FORMOU WEBOVEJ SLUŽBY PAVEL HOROVČÁK, JÁN TERPÁK a MATEJ LUKÁČ Technická univerzita, Letná 9, 042 00 Košice, Fakulta baníctva,
TRU Chemistry Contest Chemistry 12 May 21, 2003 Time: 90 minutes
 TRU Chemistry Contest Chemistry 12 May 21, 2003 Time: 90 minutes Last Name First name School Teacher Please follow the instructions below. We will send your teacher a report on your performance. Top performers
TRU Chemistry Contest Chemistry 12 May 21, 2003 Time: 90 minutes Last Name First name School Teacher Please follow the instructions below. We will send your teacher a report on your performance. Top performers
CHEM 107 (Spring-2004) Exam 2 (100 pts)
 CHEM 107 (Spring-2004) Exam 2 (100 pts) Name: ------------------------------------------------------------------------, SSN -------------------------------- LAST NAME, First (Circle the alphabet segment
CHEM 107 (Spring-2004) Exam 2 (100 pts) Name: ------------------------------------------------------------------------, SSN -------------------------------- LAST NAME, First (Circle the alphabet segment
Chem 401 Unit 2 Exam Spr 2018 (Acids/ Bases/ General Equilibria /Acid-Base Equilibria)
 Name: Date: Exam #: _ Chem 401 Unit 2 Exam Spr 2018 (Acids/ Bases/ General Equilibria /Acid-Base Equilibria) Multiple Choice Identify the letter of the choice that best completes the statement or answers
Name: Date: Exam #: _ Chem 401 Unit 2 Exam Spr 2018 (Acids/ Bases/ General Equilibria /Acid-Base Equilibria) Multiple Choice Identify the letter of the choice that best completes the statement or answers
The reaction whose rate constant we are to find is the forward reaction in the following equilibrium. NH + 4 (aq) + OH (aq) K b.
 THE RATES OF CHEMICAL REACTIONS 425 E22.3a The reaction for which pk a is 9.25 is NH + 4 aq + H 2Ol NH 3 aq + H 3 O + aq. The reaction whose rate constant we are to find is the forward reaction in the
THE RATES OF CHEMICAL REACTIONS 425 E22.3a The reaction for which pk a is 9.25 is NH + 4 aq + H 2Ol NH 3 aq + H 3 O + aq. The reaction whose rate constant we are to find is the forward reaction in the
Chemistry Higher level Paper 1
 N15/4/EMI/PM/ENG/TZ0/XX hemistry igher level Paper 1 Friday 13 November 2015 (afternoon) 1 hour Instructions to candidates Do not open this examination paper until instructed to do so. Answer all the questions.
N15/4/EMI/PM/ENG/TZ0/XX hemistry igher level Paper 1 Friday 13 November 2015 (afternoon) 1 hour Instructions to candidates Do not open this examination paper until instructed to do so. Answer all the questions.
VYSOKÉ UČENÍ TECHNICKÉ V BRNĚ
 VYSOKÉ UČENÍ TECHNICKÉ V BRNĚ BRNO UNIVERSITY OF TECHNOLOGY FAKULTA STROJNÍHO INŽENÝRSTVÍ FACULTY OF MECHANICAL ENGINEERING ÚSTAV PROCESNÍHO INŽENÝRSTVÍ INSTITUTE OF PROCESS ENGINEERING VÝVOJ MODELU KALCINACE
VYSOKÉ UČENÍ TECHNICKÉ V BRNĚ BRNO UNIVERSITY OF TECHNOLOGY FAKULTA STROJNÍHO INŽENÝRSTVÍ FACULTY OF MECHANICAL ENGINEERING ÚSTAV PROCESNÍHO INŽENÝRSTVÍ INSTITUTE OF PROCESS ENGINEERING VÝVOJ MODELU KALCINACE
! 94
 ! 94 4 : - : : / : : : : ( :) : : : - : / : / : : - 4 : -4 : : : : : -5 () ( ) : -6 : - - : : : () : : : :4 : -7. : : -8. (. : ( : -9 : ( ( ( (5 (4 4 : -0! : ( : ( :. : (. (. (. (4. ( ( ( : ( 4 : - : :
! 94 4 : - : : / : : : : ( :) : : : - : / : / : : - 4 : -4 : : : : : -5 () ( ) : -6 : - - : : : () : : : :4 : -7. : : -8. (. : ( : -9 : ( ( ( (5 (4 4 : -0! : ( : ( :. : (. (. (. (4. ( ( ( : ( 4 : - : :
The exam must be written in ink. No calculators of any sort allowed. You have 2 hours to complete the exam. Periodic table 7 0
 Email: The exam must be written in ink. No calculators of any sort allowed. You have 2 hours to complete the exam. CEM 610B Exam 3 Spring 2002 Instructor: Dr. Brian Pagenkopf Page Points 2 6 3 7 4 9 5
Email: The exam must be written in ink. No calculators of any sort allowed. You have 2 hours to complete the exam. CEM 610B Exam 3 Spring 2002 Instructor: Dr. Brian Pagenkopf Page Points 2 6 3 7 4 9 5
5.111 Principles of Chemical Science
 MIT OpenCourseWare http://ocw.mit.edu 5.111 Principles of Chemical Science Fall 2008 For information about citing these materials or our Terms of Use, visit: http://ocw.mit.edu/terms. Page 1 of 10 pages
MIT OpenCourseWare http://ocw.mit.edu 5.111 Principles of Chemical Science Fall 2008 For information about citing these materials or our Terms of Use, visit: http://ocw.mit.edu/terms. Page 1 of 10 pages
8. Relax and do well.
 CHEM 1314 Name Exam IV TA Name John IV. Gelder December 14, 1992 Lab Section INSTRUCTIONS: 1. This examination consists of a total of 9 different pages. The last three pages includes a periodic table and
CHEM 1314 Name Exam IV TA Name John IV. Gelder December 14, 1992 Lab Section INSTRUCTIONS: 1. This examination consists of a total of 9 different pages. The last three pages includes a periodic table and
CHEM 251 (Fall-2003) Final Exam (100 pts)
 CEM 251 (Fall-2003) Final Exam (100 pts) Name: -------------------------------------------------------------------------------, SSN -------------------------------- LAST NAME, First (Circle the alphabet
CEM 251 (Fall-2003) Final Exam (100 pts) Name: -------------------------------------------------------------------------------, SSN -------------------------------- LAST NAME, First (Circle the alphabet
(please print) (1) (18) H IIA IIIA IVA VA VIA VIIA He (2) (13) (14) (15) (16) (17)
 CHEM 10113, Quiz 3 September 28, 2011 Name (please print) All equations must be balanced and show phases for full credit. Significant figures count, show charges as appropriate, and please box your answers!
CHEM 10113, Quiz 3 September 28, 2011 Name (please print) All equations must be balanced and show phases for full credit. Significant figures count, show charges as appropriate, and please box your answers!
Chem 112, Fall 05 Exam 2a
 Name: YOU MUST: Put your name and student ID on the bubble sheet correctly. Put all your answers on the bubble sheet. Please sign the statement on the last page of the exam. Please make sure your exam
Name: YOU MUST: Put your name and student ID on the bubble sheet correctly. Put all your answers on the bubble sheet. Please sign the statement on the last page of the exam. Please make sure your exam
2. Explain why the ph of unbuffered water is generally around 5.7
 CHEM 108b FINAL EXAM The exam is worth a total of 100 points. Each problem is worth five points. Show all work for partial credit. Don t forget to label units and check whether equations are balanced if
CHEM 108b FINAL EXAM The exam is worth a total of 100 points. Each problem is worth five points. Show all work for partial credit. Don t forget to label units and check whether equations are balanced if
